微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)写出下列物质溶于水的电离方程式①冰醋酸溶于水:______;②碳酸氢钠溶于水:______.
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为:______.
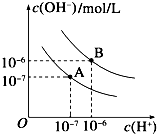
(3)已知水在25℃和95℃时,其电离平衡曲线如图所示:
①则25℃时水的电离平衡曲线应为______(填“A”或“B”),请说明理由______.
②95℃时,0.1mol?L-1的硫酸溶液中,由水电离产生的氢离子的浓度是______.
③曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.则HA属于:______(填“强酸”、“弱酸”或“无法确定”).
参考答案:(1)①醋酸属于弱电解质,存在电离平衡,电离方程式为:CH3COOH?CH3COO-+H+,故答案为:CH3COOH?CH3COO-+H+;
②碳酸氢钠属于强电解质,电离方程式为:NaHCO3=Na++HCO3-,故答案为:NaHCO3=Na++HCO3-;
(2)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成CO2和液态水时放热22.68kJ×32=725.76kJ,1mol甲醇质量为32克,所以完全燃烧1mol甲醇生成二氧化碳和液态水放热725.76KJ,甲醇燃烧热的热化学方程式为:CH3OH(l)+32O2(g)=CO2(g)+2H2O(l)△H=-725.76 kJ?mol-1,
故答案为:CH3OH(l)+32O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ?mol-1;
(3)①25℃c(H+)=c(OH-)=1×10-7,A符合,水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性;
故答案为:A;水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小;
②95℃时,0.1mol?L-1的硫酸溶液中,氢离子浓度为:0.2mol/L,硫酸溶液中水电离的氢离子浓度等于溶液中氢氧根离子的浓度,
该温度下水的离子积为:c(H+)×c(OH-)=1×10-6×1×10-6=1×10-12,溶液中氢氧根离子的浓度为:1×10-120.2=5×10-12mol?L-1,
故答案为:5×10-12mol?L-1;
③曲线B对应温度下,水的离子积为1×10-12,pH=2的某HA溶液中氢离子浓度为0.01mol/L;pH=10的NaOH溶液中氢氧根离子的浓度为0.01mol/L,两种溶液中氢离子浓度与氢氧根离子浓度相等,等体积混合后,混合溶液的pH=5,说明HA过量,原pH=2的某HA溶液中氢离子浓度为0.01mol/L,是HA部分电离的,属于HA属于弱酸,
故答案为:弱酸.
本题解析:
本题难度:一般
2、填空题 过氧化氢是重要的工业产品和实验室常用试剂。
(1)制取H2O2的方法很多,下列制取方法具有绿色环保,原子利用率最高的是_____________。
a.BaO2+H2SO4=BaSO4↓+H2O2
b.K2S2O8+2H2O=2KHSO4+H2O2
c.Na2O2+H2SO4+10H2O=Na2SO4·10H2O+H2O2
d.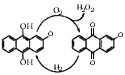
(2)H2O2水溶液具有弱酸性,其电离方程式为:_____________________。
(3)取氢气还原氧化铜后所得红色固体产物7.80g(含有Cu和并可能含有少量Cu2O、CuO),将其均分为两等份。一份在空气中灼烧到恒重为4.86g;另一份用含17%H2O2的酸性溶液至少_____________g,方可完全溶解,得蓝色溶液。
(4)为测定某钙片中H2O2残留,取25片(1.0g/片),研细、溶解、配成溶液250.00mL。取25.00mL,用0.01000mol·L-1酸性高锰酸钾溶液滴定(除H2O2外,其它物质不参与反应),耗去20.00mL。则钙片中H2O2残留为_______________mg/片。
参考答案:(1)d
(2)H2O2 H++HO2-(或2H2O2
H++HO2-(或2H2O2 H3O2++HO2-)?
H3O2++HO2-)?
(3)12.0
(4)6.8
本题解析:
本题难度:一般
3、选择题 常温下,在0.1 mol·L-1的CH3COOH溶液中,水的离子积是 ( )
A.1×10-14
B.1×10-13
C.1.32×10-14
D.1.32×10-15