微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 我国是第一产煤、用煤大国。但是,煤燃烧时会释放出大量的污染性或温室气体,如NOx、SO2、CO2等。如果对燃煤进行适当处理,既有利于实现绿色环保、节能减排的目标,又可达到变废为宝,节约资源的目的。
(1)利用甲烷催化还原NOx:
①CH4+4NO2=4NO+CO2+2H2O
②CH4+____NO=____+____CO2 +____H2O
请将反应②的化学方程式补充完整。
(2)利用NaOH溶液可吸收废气中的SO2。某火力发电厂每天排放的1. 12×104m3(标准状况下)尾气中含 0.2%(体积百分数)的SO2。则用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到石膏(CaSO4·2H2O)__________kg。
(3)将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0 在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H<0 在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。

①0~3min内,v(H2)=_______
②该条件下反应的平衡常数为________
③达到平衡时,气体条件不变的情况下增大压强,平衡常数______(填“增大”、“减小”或“不变”)。
参考答案:(1)4、2N2、1、2
(2)172
(3)①0.5 mol/(L·min);②5.33;③不变
本题解析:
本题难度:一般
2、选择题 一定温度下的定容容器中,反应A2(g)+B2(g)

?2AB(g)达到平衡标志的是( )
A.单位时间内生成2nmolAB同时消耗nmolB2
B.单位时间总物质的量不随时间的变化而变化
C.单位时间内生成nmolA2同时消耗nmolB2
D.容器内各组分的物质的量不随时间的变化而变化
参考答案:A、无论该反应是否达到平衡状态,消耗nmolB2的同时一定生成2nmolAB,故A错误.
B、该反应是一个反应前后总物质的量不变的化学反应,所以无论反应是否达到平衡状态总物质的量不随时间的变化而变化,故B错误.
C、单位时间内生成nmolA2同时生成nmolB2,且同时消耗nmolB2,所以B2的正逆反应速率相等,达到平衡状态,故C正确.
D、容器内各组分的物质的量不随时间的变化而变化,就说明了该反应达到平衡状态,故D正确.
故选CD.
本题解析:
本题难度:简单
3、填空题 (8分)甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物。工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g) CH3OH(g) △H="a" kJ/mol
CH3OH(g) △H="a" kJ/mol
为研究平衡时CO的转化率与反应物投料比(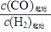 )及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图:
)及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图:
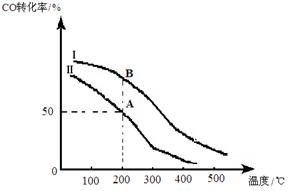
(1)反应热a 0 (填“>”或“<”),判断依据是 。
(2)若其它条件相同,Ⅰ、Ⅱ曲线分别表示投料比不同时的反应过程。
①投料比:Ⅰ Ⅱ (填“>”或“<”)。
②若Ⅱ反应的n(CO)起始 ="10" mol、投料比为0.5,
A点的平衡常数KA= ,
B点的平衡常数KB KA (填“>”或“<”或“=”)。
(3)为提高CO转化率可采取的措施是 (至少答出两条)。
参考答案:(1)<;升高温度,CO的转化率降低, 平衡左移,正反应为放热反应。(各1分,共2分)
(2)① < (2分) ② 1,= (各1分,共2分)
(3)减小投料比、较低温度、增大压强、分离出CH3OH (一条1分,共2分)
本题解析:(1)根据图像可知在压强相同的条件下,升高温度,CO的转化率降低, 这说明平衡左移,因此正反应为放热反应。
(2)①由于最大氢气的浓度有利于提高CO的转化率,所以根据图像可知曲线在温度相等的条件下曲线I的转化率大,所以投料比:Ⅰ<Ⅱ。
②若Ⅱ反应的n(CO)起始=10 mol、 投料比为0.5,则氢气是20mol。A点转化率是0.5,即消耗5molCO,则同时消耗1mol氢气,生成5mol甲醇。所以平衡时CO、氢气、甲醇的浓度分别是0.5mol/L、1mol/L、0.5mol/L,则A点的平衡常数KA=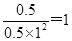 ;平衡常数只与温度有关系,则B点的平衡常数KB=KA 。
;平衡常数只与温度有关系,则B点的平衡常数KB=KA 。
(3)由于正反应是体积减小的放热反应,所以为提高CO转化率可采取的措施是减小投料比、较低温度、增大压强、分离出CH3OH等。
考点:考查外界条件对平衡状态的影响、平衡常数计算等
本题难度:困难
4、选择题 某温度下,密闭容器中发生反应aX(g) 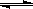 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是?
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是?
A.可逆反应的化学计量数数:a>b+c
B.压缩容器的容积时,v正增大,v逆减小
C.达到新平衡时,物质X的转化率减小
D.达到新平衡时,混合物中Z的质量分数增大
参考答案:C
本题解析:恒温下,体积缩小为原来的一半,假设原反应的平衡不移动,则物质Y和Z的浓度将均增加至原来的2倍,而实际上Y、Z的浓度均为原来的1.8倍,说明平衡向逆反应方向移动,因而X的转化率减小,Z的质量分数减小。因体积减小(即压强增大),正、逆反应速率均增大,且化学平衡是向着气体物质的物质的量减少的方向移动,有a<b+c。[点拨]如果已知压强改变后浓度变化情况,可先看平衡不移动时压强改变后浓度应该变化, 再由实际情况即可确定压强对平衡的影响。
本题难度:简单
5、填空题 (8分)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)  2SO3(g) △H=-190 kJ·mo1-1
2SO3(g) △H=-190 kJ·mo1-1
(1)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则v(O2)= mol·L-1·min-1
(2)下列条件的改变能加快其反应速率的是 (选填序号)
①升高温度 ②保持体积不变,只增加氧气的质量
③保持体积不变,充入Ne使体系压强增大 ④保持压强不变,充入Ne使容器的体积增大
(3)下列描述中能说明上述(1)反应已达平衡的是 (选填序号)
①v(O2)正=2v(SO3)逆 ②SO2、O2、SO3的浓度之比为2:1:2
③单位时间内生成2n molSO2的同时生成2n mol SO3④容器中气体的平均分子量不随时间而变化
⑤容器中气体的密度不随时间而变化 ⑥容器中气体压强不随时间而变化
(4)在相同条件下发生上述反应,若要得到380kJ热量,则加入各物质的物质的量可能是 。
A.4 mo1SO2和2mol O2
B.6mol SO2和6mo1 O2
C.4mol SO2和4 mo1 O2
D.6mo1 SO2和4 mo1 O2