微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验能达到预期目的是( )
A.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量相等
B.实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法
C.用碳酸钠滴定未知浓度的盐酸,碳酸钠盛于酸式滴定管中
D.向煮沸的1mol?L-1NaOH溶液中滴加FeCl2饱和溶液制备Fe(OH)3胶体
参考答案:A、中和反应热的测定应使盐酸充分反应,需加入稍过量的NaOH溶液减少盐酸的挥发,减少误差,故A错误;
B、乙酸和乙醇都可溶于水,但沸点不同,可以利用蒸馏将两者分离,但乙酸和乙醇都属于易挥发的物质,蒸馏时加生石灰的目的是为了使乙酸转变为难挥发的乙酸钙,使它在蒸馏过程中难以挥发出来,这样蒸出物中就没有乙酸了.乙酸与生石灰反应过程中生成了水,水可以和乙醇形成共沸物,可同时蒸出,因此,所用的生石灰应足够过量,使水能与生石灰反应生成难挥发的Ca(OH)2,这样,蒸出物中就只有乙醇了,故B正确;
C、碳酸钠水解呈碱性,应用碱式滴定管盛装,故C错误;
D、氢氧化铁胶体的制备方法是将饱和三氯化铁溶液滴入沸水中,铁离子立即发生水解反应,得到氢氧化铁胶体.用NaOH与
FeCl2是先生成氢氧化亚铁沉淀,氢氧化亚铁沉淀很快的被氧化成氢氧化铁沉淀.也不可以直接将饱和三氯化铁溶液直接加热到沸腾,这样也是得不到胶体的,故D错误;
故选B.
本题解析:
本题难度:一般
2、选择题 (浙江省宁波市鄞州高级中学08-09学年高三上学期期中考试,化学,21)为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
A.HCHO溶液(石蕊试液)
B.Na2SO3溶液(BaCl2)
C.KI(淀粉溶液)
D.FeCl2溶液(KSCN)
参考答案:B
本题解析:A项加入石蕊试液若变红,则HCHO溶液变质成HCOOH; B项中缺少稀盐酸,不能达到目的;C项加入淀粉溶液若变蓝,则KI氧化变质成I2;D项加入KSCN溶液后,若溶液变血红色,则FeCl2溶液氧化变质FeCl3溶液。
本题难度:简单
3、选择题 工业上采用湿法炼锌过程中,以ZnSO4为主要成分的浸出液中,含有Fe3+、Fe2+、Cu2+、Cl-等杂质,这些杂质对锌的电解工序有妨碍,必须事先除去。现有下列试剂可供选择:
①酸性KMnO4溶液②NaOH溶液③ZnO④H2O2溶液⑤Zn⑥Fe⑦AgNO3⑧Ag2SO4
下列说法不正确的是
[? ]
A.用酸性KMnO4溶液将Fe2+氧化成Fe3+,再转化为Fe(OH)3沉淀除去
B.用ZnO调节浸出液的酸碱性,可使某些离子形成氢氧化物沉淀
C.在实际生产过程中,加入AgSO4可除去Cl-,是利用了沉淀转化的原理
D.也可以用ZnCO3代替ZnO调节溶液的酸碱性
参考答案:A
本题解析:
本题难度:一般
4、选择题 一定质量的某硝酸钾样品中不含可溶性杂质,在10℃时加一定量蒸馏水使之充分溶解,残留固体的质量为250g,若升温至40℃,残留固体的质量为120g;升温至70℃,残留固体的质量为20g.已知KNO3在不同温度下的溶解度:
A.该硝酸钾样品一定为纯净物
B.40℃时溶于水的硝酸钾为130g
C.70℃硝酸钾溶液为饱和溶液
D.55℃左右时硝酸钾完全溶解
参考答案:D
本题解析:分析:根据硝酸钾不同温度下的溶解度差值,利用已知温度段10℃到40℃的硝酸钾的溶解量增加值计算温度段40℃到70℃的溶解度增加值,与题目中实际增加值比较,可知道70℃硝酸钾溶液还未达到饱和,存在杂质,杂质质量为20g,通过40℃到55℃溶解度增加值,算出55℃左右硝酸钾恰好完全溶解.
解答:A.从10℃到40℃,硝酸钾溶解度增大了45g,溶解的硝酸钾增加了250-120=130 g,从40℃到70℃,硝酸钾的溶解度增大了140g-65g=75g,
硝酸钾达到饱和需要的溶解量为130÷45×75=216.67g,溶解的硝酸钾增加了120-20=100 g,小于216.67g,说明硝酸钾已经溶解完毕,残余固体为杂质,故A错误;
B.从10℃到40℃,溶解的硝酸钾增加了250-120=130 g,10℃时已有部分硝酸钾溶解,故40℃时溶于水的硝酸钾为大于130g,故B错误;
C.从A选项分析可以知道,70℃时硝酸钾达到饱和需要多加216.67-100=116.7g硝酸钾,故此时不为饱和溶液,故C错误;
D.从10℃到40℃,硝酸钾溶解度增大了45,溶解的硝酸钾增加了250-120=130 g,从40℃到55℃,硝酸钾的溶解度增大了100-65=35,硝酸钾达到饱和需要的溶解量130÷45×35=101.11g,近似等于120-20=100g,故从10℃到40℃,硝酸钾溶解度增大了45,溶解的硝酸钾增加了250-120=130 g,从40℃到70℃,硝酸钾的溶解度增大了140-65=75,硝酸钾达到饱和需要的溶解量,D正确;
故选D.
点评:本题考查了硝酸钾在不同温度下的溶解度,根据溶解度差值计算增加的硝酸钾质量,判断硝酸钾是否饱和、什么时候溶解完全、是否含有杂质等即可解答.
本题难度:简单
5、实验题 (12分)下列装置是用燃烧法确定有机物分子式常用的装置。
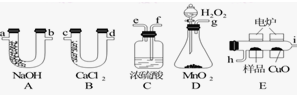
(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是_________。
(2)C装置中浓硫酸的作用是________________________。
(3)D装置中MnO2的作用是_______________________。
(4)燃烧管中CuO的作用是_____________________。
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92 g样品,经充分反应后,A管质量增加1.76 g,B管质量增加1.08 g,则该样品的实验式为_________。
(6)要确定该物质的分子式,还要知道该物质的________。经测定其蒸气密度为2.054 g/L(已换算为标准状况下),则其分子式为____________。
(7)该物质的核磁共振氢谱如图所示,则其结构简式为____________________。 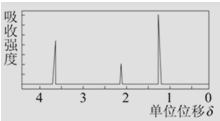
参考答案:(1)g→f→e→h→i→c(或d)→d(或c)→a(或b)→b(或a)?
(2)干燥O2?
(3)催化剂,加快O2的生成
(4)使有机物充分氧化生成CO2和H2O?
(5)C2H6O
(6)相对分子质量 C2H6O?
(7) CH3CH2OH
本题解析:
本题使用燃烧法确定有机物的分子式,采用的是实验式法,装置的连接按照“制氧气→干燥氧气→燃烧→吸收水→吸收二氧化碳”的顺序。由实验可测得二氧化碳和水的质量,就可以求出碳元素和氢元素的质量,再结合样品的总质量,就可以求出C、H、O的物质的量之比,然后求出实验式,有了实验式,要求分子式,必须知道相对分子质量。
本题难度:一般