微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 aF是一种重要的氟盐,主要用作农作物杀虫剂、木材防腐剂等。某课题组设计了以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵的实验,其工艺流程如下:
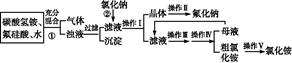
已知:20 ℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
(1)操作Ⅱ是洗涤、干燥,其目的是 ?,
操作Ⅲ和操作Ⅳ的名称依次是 (填写序号)。
a.过滤?b.加热蒸发? c.冷却结晶? d.洗涤
(2)上述流程中①的化学反应方程式:
H2SiF6+ NH4HCO3 NH4F+? H2SiO3↓+ CO2↑+ ?
NH4F+? H2SiO3↓+ CO2↑+ ?
(3)流程①中NH4HCO3必须过量,其原因是? 。
(4)若不考虑氟化钠的溶解,7.2 g氟硅酸理论上最多能生产 g氟化钠。
参考答案:(1)除去氟化钠表面的氯化氨杂质 bc
(2)1 6 6 1 6 3 H2O
(3)保证H2SiF6能全部反应,防止在加入NaCl时生成Na2SiF6沉淀
(4)12.6
本题解析:从整个的流程图以及最后得到的产物来看,经①生成的气体是CO2,得到的沉淀是Si元素形成的沉淀。过滤后的滤液中存在F-、N ,加入足量氯化钠后由于氟化钠的溶解度很小,而NaCl、NH4Cl溶解度都较大,所以会生成NaF沉淀;操作Ⅰ是过滤,得到NaF晶体和NH4Cl溶液,操作Ⅱ是洗涤,以除去NaF晶体表面的Cl-、N
,加入足量氯化钠后由于氟化钠的溶解度很小,而NaCl、NH4Cl溶解度都较大,所以会生成NaF沉淀;操作Ⅰ是过滤,得到NaF晶体和NH4Cl溶液,操作Ⅱ是洗涤,以除去NaF晶体表面的Cl-、N 。NH4Cl溶解度较大,需要进行蒸发浓缩、冷却结晶而析出NH4Cl,然后可通过重结晶得到纯净的NH4Cl。在流程①中加入过量NH4HCO3是考虑让H2SiF6完全转化为NH4F,根据原子守恒:m(NaF)=
。NH4Cl溶解度较大,需要进行蒸发浓缩、冷却结晶而析出NH4Cl,然后可通过重结晶得到纯净的NH4Cl。在流程①中加入过量NH4HCO3是考虑让H2SiF6完全转化为NH4F,根据原子守恒:m(NaF)=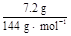 ×6×42 g· mol-1="12.6" g。
×6×42 g· mol-1="12.6" g。
本题难度:一般
2、选择题 下列实验操作中错误的是
A.用酒精萃取碘水中的碘
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上
参考答案:A
本题解析:选择萃取剂,一般与水互不相溶,要萃取的物质在萃取剂中溶解度比水中要大,当然还要易于分离,酒精与水互溶,A错;其余都是常见分离中应该注意的细节,是常考的要点。
本题难度:一般
3、实验题 掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
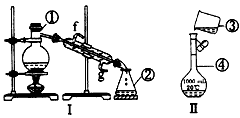
(1)写出下列仪器的名称: ①_______________,②______________,④_____________。
(2)仪器①~④中,使用时必须检查是否漏水的有______________(填序号)。
(3)若利用装置工分离四氯化碳和酒精的混合物,还缺少的仪器有_____________,将仪器补充完整后进行的实验操作的名称为____________;冷凝管的进水口是____________(填“f”或“g”);现需配制
250 mL 0.2 mol/L NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,图中的错误是_____________。
参考答案:(1)蒸馏烧瓶;锥形瓶;1000 mL的容量瓶
(2)④
(3)温度计;分馏;g;未用玻璃棒引流,未采用250mL的容量瓶
本题解析:
本题难度:一般
4、选择题 有下列五瓶溶液,其所含离子、分子总数的大小顺序是
①10mL?0.60?mol·L-1NaOH水溶液? ②20mL?0.50?mol·L-1?H2SO4水溶液?
③30mL?0.40?mol·L-1?HCl水溶液? ④40mL?0.30?mol·L-1?CH3COOH溶液? ⑤50mL?0.20?mol·L-1蔗糖水溶液
A.①>②>③>④>⑤
B.②>①>③>④>⑤
C.②>③>④>①>⑤
D.⑤>④>③>②>①
参考答案:D
本题解析:因为问的是各瓶溶液所含离子、分子总数的大小,溶质的量小,这就取决于溶液中的水的多少,所以哪种溶液体积大,哪种所含离子、分子总数就多。故有⑤>④>③>②>①。
本题难度:简单
5、选择题 在自来水蒸馏实验中,下列操作叙述不正确的是
A.在蒸馏烧瓶中盛约1/2体积的自来水,并放入几粒碎瓷片
B.将温度计水银球插到蒸馏烧瓶中的自来水中
C.冷水应从冷凝管下口进,上口出
D.收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象
参考答案:B
本题解析:略
本题难度:简单