微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关日常生活中涉及到的化学知识的描述不正确的是( )
A.用煮面汤洗涤餐具上的油污
B.用碘水检测土豆中含有淀粉
C.用料酒清洗热水瓶中的水垢
D.利用丁达尔效应区别鸡蛋清和食盐水
参考答案:A.面汤中含有食用碱,呈碱性,油脂在碱性条件下水解,可除去,故A正确;
B.淀粉遇碘变蓝色,可用碘水检验,故B正确;
C.料酒中含有酒精,与水垢不反应,故C错误;
D.鸡蛋清具有胶体的特征,具有丁达尔效应,故D正确.
故选C.
本题解析:
本题难度:简单
2、实验题 阅读、分析下列两个材料:?
材料一?
材料二
物质
| 熔点/℃
| 沸点/℃
| 密度/g·cm-3
| 溶解性
|
乙二醇 C2H6O2
| -11.5
| 198
| 1.11
| 易溶于水和乙醇
|
丙三醇C3H8O3
| 17.9
| 290
| 1.26
| 能跟水、酒精以任意比互溶
|
根据上述材料及课本知识,回答下列问题(填写序号):
A.蒸馏法? B.萃取法? C.“溶解、结晶、过滤”的方法? D.分液法?E.层析
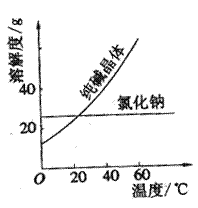
⑴将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用______________,
⑵将乙二醇和丙三醇相互分离的最佳方法是______________,
⑶用CCl4提取溴水中的溴单质的最佳方法是_____________,
⑷分离汽油和水的最佳方法是_______________。
参考答案:(1)C?(2)A?(3)B?(4)D?(每空2分)
本题解析:略
本题难度:一般
3、填空题 (共8分) A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、
Na+、Cu2+中的某一种,阴离子分别可能是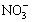 、S
、S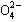 、Cl—、C
、Cl—、C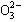 的某一种。
的某一种。
(1)若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
(2)若向(1)的四支试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有无色无味气体逸出。
根据(1) 、(2)实验事实可推断它们的化学式为:
A.??B.??C.??D.??
参考答案:(8分)? BaCl2?AgNO3?CuSO4?Na2CO3
本题解析:略
本题难度:简单
4、实验题 PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
?
| 熔点/℃
| 沸点/℃
| 密度/g·mL-1
| 其他
|
黄磷
| 44.1
| 280.5
| 1.82
| 2P(过量)+3Cl2 2PCl3;2P+5Cl2 2PCl3;2P+5Cl2 2PCl5 2PCl5
|
PCl3
| —112
| 75.5
| 1.574
| 遇水生成H3PO3和HCl,遇O2生成POCl3
|
POCl3
| 2
| 105.3
| 1.675
| 遇水生成H3PO4和HCl,能溶于PCl3
|
?
(一)制备:RU 图是实验室制备PCl3的装置(部分仪器已省略)
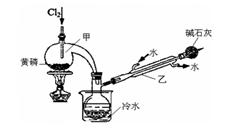
(1)仪器乙的名称____________。
(2)实验室用漂白粉加浓盐酸制备Cl2的化学方程式:_______________________ 。
(3)碱石灰的作用是____________________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一 段时间的CO2,其目的是____________________。
(二)提纯:
(5)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后,通过_________________(填实验操作名称),即可得到PCl3的纯品。
(三)分析:
测定产品中PCl3纯度的方法如下:迅速称取4.200 g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的0.1000 mol/L 20.00? mL 碘溶液,充分反应后再用0.1000 mol/L? Na2S2O3溶液滴定过量的碘,终点时消耗10.00? mL Na2S2O3溶液。
已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其他反应。
(6)根据上述数据,该产品中PCl3的质量分数为____________________ 。若滴定终点时俯视读数,则PCl3的质量分数_______(偏大、偏小、或无影响)
参考答案:(1)冷凝管?(2)Ca(ClO)2+4HCl = CaCl2+2H2O +2Cl2↑
(3)吸收多余的Cl2,防止污染环境; 防止空气中的水分进入,影响产品纯度。
(4)排尽装置中的空气,防止O2和水与PCl3反应
(5)蒸馏
(6)98.21%?偏大
本题解析:(1)仪器乙名称为:冷凝管;(2)实验室制备氯气用漂白粉和浓盐酸反应生成氯化钙、氯气和水,反应的化学方程式为Ca(ClO)2+4HCl = CaCl2+2H2O +2Cl2↑;(3)氯气有毒,污染空气,碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度;(4)根据题给信息知,PCl3遇O2会生成POCl3,遇水生成H3PO3和HCl,通入一段时间的CO2可以排尽装置中的空气,防止生成的PCl3与空气中的O2和水反应;(5) 由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离;(6)H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6,依据化学方程式可知H3PO3物质的量和PCl3的物质的量相同,和25ml H3PO3溶液反应的碘单质物质的量为(0.1000 mol/L×0.020L —1/2×0.1000 mol/L×0.010L)=0.0015mol,500ml溶液中PCl3的物质的量=H3PO3物质的量=碘单质物质的量为0.0015mol×20=0.03mol,PCl3质量为4.125g,该产品中PCl3的质量分数为4.125/4.20×100%=98.21%;若滴定终点时俯视读数,所读Na2S2O3溶液的体积偏小,计算剩余的碘偏小,则PCl3的质量分数偏大。
本题难度:困难
5、选择题 检验某未知溶液中是否含有SO42-的下列操作中,合理的是(?)
A.先加硝酸酸化,再加氯化钡溶液
B.先加硝酸酸化,再加硝酸钡溶液
C.先加盐酸酸化,再加氯化钡溶液
D.先加盐酸酸化,再加硝酸钡溶液
参考答案:C
本题解析:由于硝酸具有氧化性,能把SO32-氧化生成SO42-,所以应该用盐酸酸化来排除其它离子的干扰,答案选C。
本题难度:一般