微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是
A.碳酸氢钠水解:HCO3-+H2O?H3O++CO32-
B.醋酸铵溶于水:CH3COONH4+H2O?CH3COOH+NH3?H2O
C.硫酸钙悬浊液中加入碳酸钠:CaSO4(s)+CO32-?(aq)?CaCO3(s)+SO42-?(aq)
D.硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O
参考答案:C
本题解析:分析:A、选项在是碳酸氢根离子的电离;
B、醋酸铵是强电解质完全电离;
C、沉淀转化是想更难溶的方向进行;
D、硫酸氢钠和氢氧化钡反应呈中性,按照2:1反应.
解答:A、碳酸氢钠水解:HCO3-+H2O?OH-+H2CO3 ,故A错误;
B、醋酸铵溶于水水解CH3COO-+NH4++H2O?CH3COOH+NH3?H2O,故B错误;
C、硫酸钙悬浊液中加入碳酸钠沉淀转化为碳酸钙:CaSO4(s)+CO32-?(aq)?CaCO3(s)+SO42-?(aq),故C正确;
D、硫酸氢钠溶液中滴入氢氧化钡溶液呈中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故D错误;
故选C.
点评:本题考查了离子方程式的书写方法和注意问题,注意判断电离和水解的区分,电解质的判断,沉淀转化的应用,酸式盐和碱反应的定量关系判断,题目较简单.
本题难度:一般
2、选择题 下列电离方程式错误的是
A.HCl →H+ +Cl-
B.Al(NO3)3→Al3+ +3NO3-
C.Na2CO3→2Na+ +CO32-
D.MgCl2→Mg2+ +Cl22-
参考答案:D
本题解析:试题分析:D应该为MgCl2→Mg2+ +2Cl2-。
考点:离子方程式的书写
本题难度:简单
3、选择题 下列说法错误的是( )
A.在分子组成上相差一个或若干个CH2原子团的物质互称为同分异构体
B.离子方程式可以表示同一类型的离子反应,它反映了离子反应的实质
C.元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果
D.物质的性质是影响参加反应的物质的化学反应速率的重要因素
参考答案:A、同分异构体分子式相同,在分子组成上不可能相差一个或若干个CH2原子团,故A错误;
B、碳酸钠、碳酸钾分别和氢氧化钙的离子反应方程式相同,但化学反应方程式不同,所以离子反应它不仅能表示一定物质间的某个反应,而且可以表示同一类型的离子反应,反映离子反应的本质,故B正确;
C、元素性质是由原子结构决定的,元素周期律的实质是元素的原子核外电子排布周期性变化,故C正确;
D、影响化学反应速率的因素:主要因素:反应物本身的性质,外界因素:温度、浓度、压强、催化剂、反应物颗粒大小、反应物之间的接触面积和反应物状态,决定因素是物质本身的性质,外界条件只是影响因素,故D正确.
本题解析:
本题难度:一般
4、选择题 下列离子方程式中正确的是
A.硫化亚铁放入盐酸中?S2-+2H+→H2S↑
B.硫酸铜溶液中通入硫化氢?Cu2++H2S→CuS↓+2H+
C.氯化铝溶液中加入过量氯水?Al3++4NH3?H2O→AlO2-+4NH4++2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液?HCO3-+OH-→CO32-+H2O
参考答案:B
本题解析:分析:A、硫化亚铁是难溶于水的物质;
B、硫化铜难溶于硫酸;
C、氢氧化铝是两性氢氧化物不能溶于弱碱;
D、酸式盐和碱反应量少的全部反应.
解答:A、硫化亚铁放入盐酸中 FeS+2H+→H2S↑+Fe2,故A错误;
B、硫酸铜溶液中通入硫化氢反应生成硫化铜沉淀,反应的离子方程式为:Cu2++H2S→CuS↓+2H+,故B正确;
C、氯化铝溶液中加入过量氯水生成氢氧化铝沉淀,Al3++3NH3?H2O→Al(OH)3↓+3NH4+,故C错误;
D、碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+NH4++2OH-→CO32-+H2O+NH3?H2O,故D错误;
故选B.
点评:本题考查了离子方程式书写方法和正误判断,掌握物质性质是解题关键,题目难度中等.
本题难度:简单
5、选择题 常温下,向物质的量浓度均为0.1mol·L-1的盐酸和氯化钙的混合溶液中逐滴加入0.1mol/L碳酸钠溶液至沉淀刚好完全。下图中关系正确的是
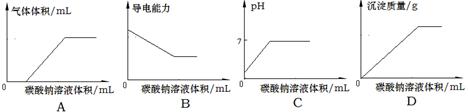
参考答案:C
本题解析:向物质的量浓度均为0.1mol/L的盐酸和氯化钙的混合溶液中不断滴入0.1mol/L碳酸钠溶液,先发生反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,立即产生气体,开始不产生沉淀,溶液的pH值增大,溶液的导电能力降低;HCl反应完毕,然后发生反应:CaCl2+Na2CO3=CaCO3↓+2NaCl,气体的体积一定,开始产生沉淀,溶液的pH不再变化,呈中性,但溶液的导电能力继续降低,A、向混合溶液中不断滴入0.1mol/L碳酸钠溶液,盐酸过量,立即产生二氧化碳气体,图象与实际不相符,故A错误;B、随碳酸钠溶液的加入,溶液的导电能力会降低,不会出现导电能力不变的情况,故B错误;C、溶液开始的pH=1,随碳酸钠加入,溶液pH增大,最后溶液呈中性,图象与实际相符合,故C正确;
D、开始不产生沉淀,HCl反应完毕,再生成沉淀,图象与实际不相符,故D错误;故选C。
本题难度:简单