微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是?,
肯定不存在的离子是_?。
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________。
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
①? H++OH-=H2O?②??
③?④? HCO3-+H+=H2O+CO2
⑤?
2、选择题 下列离子或分子在溶液中能大量共存的一组是
A.Na+、OH—、Cl2
B.Na+、Ca2+、CO32—
C.Na+、SO42—、NO3—
D.NH4+、NO3—、OH—
3、选择题 向明矾溶液中滴加氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,铝元素的存在形式是
A.一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中
B.一部分为Al(OH)3沉淀,一部分以AlO2-形式存在于溶液中
C.全部为Al(OH)3沉淀
D.几乎全部以AlO2-形式存在于溶液中
4、填空题 目前,来源:91考试网 91ExaM.org新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是?。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定。反应原理为:
Ⅰ在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Ⅱ Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
主要的生产流程如下:

①写出反应①的离子方程式?。
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)?Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)已知K2FeO4在水溶液中可以发生:4FeO42—+10H2O 4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是?。
4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是?。
(4)FeO42—在水溶液中的存在形态图如图所示。
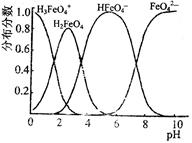
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是?。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,?转化为?(填化学式)。
5、选择题 1?L某混合溶液中,溶质X、Y浓度都为0.1mol·L-1,向混合溶液中滴加 0.1?mol/L某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是
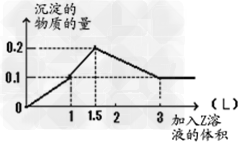
[? ]
A.偏铝酸钠、氢氧化钡、硫酸?
B.氯化铝、氯化镁、氢氧化钠
C.氯化铝、氯化铁、氢氧化钠?
D.偏铝酸钠、氯化钡、硫酸