微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下面是常见的电化学装置图,①③④中均为惰性电极,下列说法正确的是
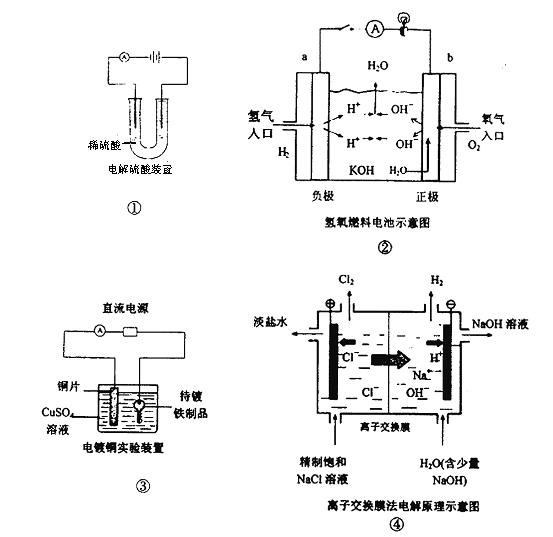
A.装置①中电解一段时间后,溶液的PH不变。
B.装置②中b极为正极,该极的电极反应方程式为O2+4H++ 4e-=2H2O
C.装置③中铜片为阳极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol
电子转移,此时铜片和铁制品的质量差为128g
D.装置④中阳离子交换膜上每透过1mol Na+时,则阴极上产生11.2L H2
参考答案:C
本题解析:A项,电解稀硫酸实质是电解水,电解过程中,硫酸的物质的量不变,溶液的体积减少,H+的浓度增大,溶液的PH减少;B项,该电池的电解质溶液为KOH溶液,故该极的电极反应式应为O2+2H2O+4e-=4OH-;C项,阴极反应式:Cu2++2e-="Cu" ,即2mol电子转移时铜片质量增加64克,阳极反应式:Cu-2e-= Cu2+,当2mol电子转移时,铜片质量减少64克,故铜片和铁制品的质量差为128g。D项,阳离子交换膜上每透过1mol Na+时,电子转移1mol,据阴极反应式:2H+ + 2e-+ =H2 ↑,若在标准状况下,产生11.2L H2,但题意中无此条件,故D项错。
本题难度:一般
2、填空题 从H+、K+、Cu2+、Cl-、SO 中选取适当的离子组成符合下列情况的电解质,进行电解(阳离子只能使用一次)。
中选取适当的离子组成符合下列情况的电解质,进行电解(阳离子只能使用一次)。
(1)以碳棒为电极进行电解,电解质的物质的量减少,水的物质的量保持不变,两极都有气体生成,气体体积相同,则该电解质的化学式为____________,电解的阴极反应____________,电解的阳极反应________________________,电解的总方程式是______________________。
(2)以铂丝为电极进行电解,水的物质的量减少,电解质的物质的量保持不变,两极都有气体生成,气体体积比为2:1,则该电解质的化学式为____________________,阴极反应式为____________________,阳极反应式为___________________________。
(3)惰性电解,电解质的物质的量减少,水的物质的量也减少,pH下降,则电解质的化学式为____________,电解的总方程式为__________________________________。
参考答案:10分(每空1分,最后一空2分)
(1)HCl ;2H++2e-=H2↑?;2Cl--2e-=Cl2↑ ; 2HCl H2↑+Cl2↑
H2↑+Cl2↑
(2)K2SO4 ;4H++4e-=2H2↑?;4OH--4e-=2H2O+O2↑
(3)CuSO4 2CuSO4+2H2O 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
本题解析:阳离子放电顺序为Cu2+>Na+>H+,阴离子放电顺序为Cl->OH->SO42-。
(1) 电解质的物质的量减少,水的物质的量保持不变,两极都有气体生成,气体体积相同,说明电解的HCl,铜离子、氯离子放电,则电解质质量减小,水量不变,故电解质的化学式为HCl,电解的阴极反应为2H++2e-=H2↑,电解的阳极反应为2Cl--2e-=Cl2↑,电解的总方程式是2HCl H2↑+Cl2↑。
H2↑+Cl2↑。
(2) 以铂丝为电极进行电解,水的物质的量减少,电解质的物质的量保持不变,两极都有气体生成,气体体积比为2:1,说明电解的是)K2SO4,氢离子、氢氧根离子放电,则电解质质量不变,水量减少,故该电解质的化学式为K2SO4,阴极反应式为4H++4e-=2H2↑,阴极反应式为4OH--4e-=2H2O+O2↑。
(3)惰性电解,电解质的物质的量减少,水的物质的量也减少,pH下降,说明电解的是CuSO4,则铜离子、氢氧根离子(或氯离子、氢离子)放电,所以电解质和水量都减少,故电解质的化学式为CuSO4,电解的总方程式为2CuSO4+2H2O 2Cu+O2↑+2H2SO4。
2Cu+O2↑+2H2SO4。
点评:本题考查电解原理,明确离子的放电顺序是解答本题的关键,注意电极材料与发生的电极反应即可解答,题目难度大。
本题难度:一般
3、填空题 (15分)有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大4,元素Z形成的金属单质在日常生活中应用最广泛。请回答:
Ⅰ.若X是短周期最活泼的金属元素。
(1)写出Y的单质的结构式 。
(2)写出单质Z与元素Y的最高价氧化物对应的水化物(稀溶液,过量)反应的离子方程式 。
Ⅱ.若X的简单离子半径是第三周期元素简单离子半径最小的。
(3)在定向爆破中,常利用氧化铁和单质X反应放出的热量来切割钢筋。该反应的化学方程式为 。
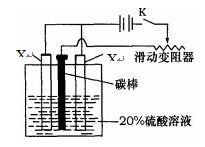
(4)已知X的阳极氧化是一种常用的金属表面处理技术,它能使X的表面形成致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中模拟该处理过程,装置如图所示,该阳极的电极反应式为 。
Ⅲ.含Z的化合物A(化学式为K2ZO4)极易溶于水,但静置一段时间后转化为红褐色沉淀,同时产生O2。
(5)化合物A溶于水后的变化 (用离子方程式表示)。查阅资料发现,加入下列物质中的 可提高A在水中的稳定性。
A.Na2CO3
B.KSCN
C.NH4NO3
D.KOH