微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确 的是
的是

A.Z元素的原子半径可能比Y元素的原子半径小
B.Z元素的最高化合价可能比Y元素的高
C.W的气态氢化物的稳定性一定比Y的强
D.Z的最高价氧化物的水化物的酸性一定比W的强
参考答案:B
本题解析:略
本题难度:一般
2、选择题 下列说法正确的是? ( ? )
A.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质
相似
B.Fe3+的最外层电子排布式为:3s23p63d5
C.基态铜原子的轨道表示式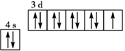
D.基态碳原子的轨道表示式
参考答案:B
本题解析:
正确答案:B
A、不正确,He化学性质不活泼
B、正确;
C、不正确,基态铜原子的轨道表示式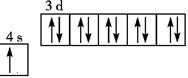
D.不正确,基态碳原子的轨道表示式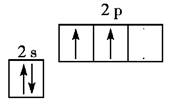
本题难度:简单
3、填空题 (9分)有x、Y、Z、M、R、Q六种短周期主族元素,部分信息如下表所示:
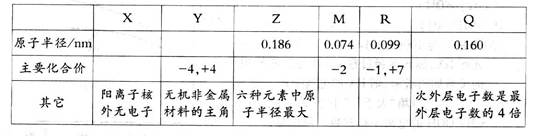
请回答下列问题:
(1)R在元素周期表中的位置是________________________________.
(2)根据表中数据推测,Y的原子半径的最小范围是_________________________.
(3)Z、M、Q的简单离子的离子半径的大小顺序为________________ (用元素符号表示)。
(4)Y与R相比,非金属性较强的是_________ (用元素符号表示),下列事实能证明这一结
论的是__________ (选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX。
c.Y与R形成的化合物中Y呈正价
(5)X、M、Z三种元素组成的化合物中含有的化学键为________;写出R的单质与上
述化合物的水溶液反应的离子方程式:
__________________________________________________________________________。
参考答案:(9分)(1)第三周期VIIA族(1分)
(2)大于0.099nm?小于0.160nm(1分)
(3)O2>Na+>Mg2+(1分)
(4)C1(1分);b.c(全对2分,有错不得分)
(5)离子键、共价健(2分);Cl2+2OH =Cl-+ClO-+H2O(1分)
=Cl-+ClO-+H2O(1分)
本题解析:略
本题难度:一般
4、选择题 有a、b、c、d四种金属,用导线两两相连插入稀硫酸中可以组成原电池, a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,a极发生氧化反应;b、d相连时,b极有大量气泡生成。则四种金属的活动性按由强到弱顺序排列的是(? )
A.a>b>c>d
B.a>c>d>b
C.c>a>b>d
D.b>d>c>a
参考答案:B
本题解析:考查金属活动性比较。在原电池中较活泼的金属作负极,方式氧化反应,电子从负极通过导线流向正极,而电流方向正好相反。、b相连时,a为负极,则活泼性a大于b。c、d相连时,电流由d到c,说明d是正极,活泼性是c大于d。a、c相连时,a极发生氧化反应,a是负极,活泼性是a大于c。b、d相连时,b极有大量气泡生成,说明b是正极,氢离子放电生成氢气,活泼性是d大于b,综上所叙活泼性顺序为a>c>d>b。
本题难度:一般
5、填空题
a
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
b
| 
| 
| c
| d
| e
| f
| ?
|
g
| ?
| h
| ?
| ?
| ?
| ?
| ?
|
(1)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式?。
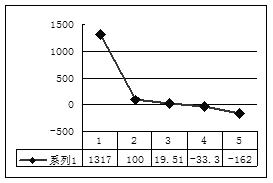
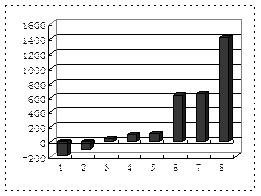
(2)第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图,已知柱形“1”代表Ar),则其中序列“2”代表?,“8”代表?。(均填化学式)
(3)b、c、d、e、f的氢化物的沸点直角坐标图(上右图),序列“5”氢化物的化学式为?,序列“1”的氢化物的电子式:?。
(4)单质a和单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质a在该燃料电池的______极发生电极反应,电极反应式为____________________________。
参考答案:(1)2OH—+2Al+2H2O=2AlO2—+3H2↑?(2)Cl2? Si
(3)CH4? Li+[∶H]— ?(4)负极;H2-2e-==2H+,或:H2+2OH--2e-==2H2O
本题解析:本题是考查综合应用元素周期表知识的能力题。根据元素周期表知识可判断,a、b、c、d、e、f、g、h八种元素分别为H、Li、C、N、O、F、Na 、Al,则g元素最高价氧化物水化物为NaOH,与h反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+ 3H2↑; 第三周期的八种元素分别为Na、Mg、Al、Si、P、S、Cl、Ar, 根据物质的聚集状态和晶体类型可判断,除Ar外, Cl2常温下为气态熔点最低,Si为原子晶体,熔点最高,则“2”代表Cl2,“8”代表Si;b、c、d、e、f的氢化物分别为LiH、CH4、NH3、H2O、HF,因为LiH为离子化合物,所以沸点最高,序列“1”为LiH;又因NH3、H2O、HF 分子结构中都含氢键,沸点比其他气态氢化物高,所以沸点最低的序列“5”为CH4;氢氧燃料电池,负极为H2、正极为O2,电解质为碱液时的负极反应式为H2-2e-==2H+,或:H2+2OH--2e-==2H2O
本题难度:一般