微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量99.97%的11种大量元素全部位于元素周期表前20号元素,其余0.03%是由10多种人体不可缺少的微量元素组成。现有a~g 7种短周期元素,是除氧、硫、钾、钙外的其他大量元素,它们在元素周期表中的位置如下,请据此回答下列问题:
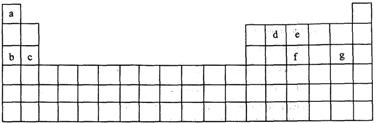
(1)元素的原子间反应最容易形成离子键的是下列中的(?),元素的原子间反应容易形成共价键的是下列中的(?)
A.c和f? B.b和g? C.d和g? D.d和e
(2)下列由a~g形成的各分子中,所有原子都满足最外层为8电子结构的是A.ea3? B.ag? C.fg3? D.dg4
(3)由11种元素的几种非金属元素构成的离子化合物的电子式为___?___。
(4)c与e可形成一种化合物,试根据原子结构写出该化合物的化学式 ,
化学键类型为 ,与稀盐酸反应的方程式为? ?。
参考答案:(共15分) (1)B (2分) C (2分) (2)CD(2分)
(3) (2分)
(2分)
(4)Mg3N2(2分) 离子键?(2分)
Mg3N2+8HCl=3MgCl2+2NH4Cl(3分)
本题解析:略
本题难度:一般
2、选择题 碳元素有三种原子: 、
、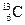 、
、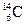 ,则三种原子具有不同的
,则三种原子具有不同的
A.核电荷数
B.中子数
C.电子层数
D.核外电子数
参考答案:B
本题解析:略
本题难度:简单
3、填空题 X、Y、Z、W四种短周期元素在元素周期表的位置如图。其中W的原子序数是Y的2倍。
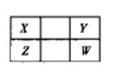
(1)W离子的结构示意图为____________。
(2)X的最简单氢化物与Cl2发生取代反应的化学方程式为(写一个)________________。
(3)能证明X、Z两元素非金属性强弱的离子方程式为__________________________。
(4)一定条件下,在密闭容器中,充入一定量的XY2(g)和XY (g),发生反应:
WY2(g)+2XY(g) 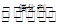 2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:
2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:

②若温度升高到T2oC时,反应的平衡常数为6.64,则该反应的正反应为_______反应(填 “吸热”或“放热”)。
(5)① 25℃、101 kPa,l mol金属镁完全燃烧放出300.0 kJ热量,1 mol单质X完全燃烧放出393.5 kJ热量。金属镁与X的最高价氧化物反应的热化学方程式为_________。
②室温下,Mg(OH) 2饱和溶液_________(填“能”或“不能”)使酚酞试液变红,通过计算说明原因(已知:Ksp[Mg(OH) 2]=4.0×10-12)。答__________________________
参考答案:
(1)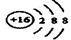
(2)CH4 + Cl2 →? CH3Cl+HCl
(3)CO2+SiO32-+H2O= CO32-+H2SiO3↓
(4)吸热
(5)2Mg(s)+ CO2(g) =" 2MgO(s)+C(s)" △H=-206.5kJ/mol
(6)能? Ksp[Mg(OH)2]=4.0×10-12=c(Mg2+)×c2(OH-)?
1/2c3(OH-)= 4.0×10-12
?c(OH-) =2.0×10-4
pOH=3.7?
pH=14-3.7=10.3?
酚酞的变色范围为8.2——10,故变红。
本题解析:W、Y同主族,且W的原子序数是Y的2倍,只有O、S符合,X、Y、Z、W分别为C、O、Si、S。(2)X的最简单氢化物为甲烷,甲烷与氯气发生取代反应,生成CH3Cl、CH2Cl2、CHCl3、CCl4;(3)比较元素非金属性强弱可以根据最高价氧化物对应水化物酸性、与氢气化合的能力、氢化物稳定性及单质的置换反应;能证明X、Z两元素非金属性强弱的反应可以从强酸制弱酸和常温条件下的单质置换反应处理,本题可根据碳酸生成硅酸得出结论;
(4)该条件下平衡常数k=c2(XY2)/ c2(XY) c(WY2)=4.44<6.64,升高温度平衡正向移动,反应吸热;
(5)①Mg(s)+1/2O2(g)=" MgO(s)" △H="-300.0" kJ/mol
②C(s)+O2(g)= CO2(g) △H="-393.5" kJ/mol
①×2-②得出2Mg(s)+ CO2(g) =" 2MgO(s)+C(s)" △H=-206.5kJ/mol
②Ksp[Mg(OH)2]=4.0×10-12=c(Mg2+)×c2(OH-)? 1/2c3(OH-)= 4.0×10-12?c(OH-) =2.0×10-4
pOH=3.7? pH=14-3.7=10.3?酚酞的变色范围为8.2——10,故变红。
本题难度:一般
4、选择题 已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径:A>B>D>C
B.单质的还原性:A>B>D>C
C.原子序数:d>c>b>a
D.离子半径:C>D>B>A
参考答案:D
本题解析:A为镁,B为钠,C为氮,D为氟。电子层数越多,半径越大,电子层数相同时,半径随原子序数的增大而减小,半径越小,其对应的氧化性,非金属性,酸性,热稳定性就越强,半径越大,其对应的还原性,金属性,碱性就越强,因此答案选D
本题难度:一般
5、选择题 在元素周期表中,从ⅢA族的硼到ⅦA族的砹作一条斜线,即为金属与非金属的分界线,依据规律应在这一条分界线附近寻找的是(? )
A.新型催化材料
B.半导体材料
C.新型耐高温材料
D.耐腐蚀的合金材料
参考答案:B
本题解析:在过渡元素中寻找催化剂和耐高温材料,以及耐腐蚀的合金材料。
本题难度:简单