微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:
①称取一定质量的HA配制0.lmol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:
①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH___________1(选填>、<、=);乙方案中,说明HA是弱电解质的现象是 。
a、装HCl溶液的试管中放出H2的速率快
b、装HA溶液的试管中放出H2的速率快
c、两个试管中产生气体速率一样快
(3)请你评价:乙方案中难以实现之处和不妥之处 、 ;
(4)请你再提出一个合理而比较容易实现的方案(可选用的药品:NaA溶液、HA溶液、稀盐酸、氢氧化钠溶液等),作简明扼要表述: 。
参考答案:(1)100mL容量瓶 (2) > ; b(3)配制pH=1的弱酸HA溶液难以实现;
不妥之处在于加入的锌粒难以做到表面积相同
(4)配制NaA溶液,在常温下测其pH>7,则说明HA是弱酸
本题解析:(1)准确配制100mL的溶液时,必须使用容量瓶,容量瓶有不同的型号,对于本题要选用100mL的容量瓶才行。
(2)甲方案中,HA是弱电解质,在溶液中只能部分电离,所以溶液中C(H+)<0.1mol/L,PH〉1;乙方案中,盐酸是强酸而醋酸是弱酸,当PH=1的盐酸和醋酸稀释相同的倍数时,由于醋酸存在电离平衡而盐酸不存在电离平衡,因而醋酸中存在的电离平衡向右移动,导致盐酸中C(H+)小于醋酸中C(H+),所以醋酸放出氢气快。选b;
(3)由于HA是弱电解质,因而其电离程度的大小不但与其本身的性质有关,而且还受温度、浓度的影响,所以HA溶液中的C(H+)只能测定而不能准确配制;再者锌粒的质量和纯度可以称量或测定,但锌粒的形状、大小则很难控制;
(4)可以从盐类的水解角度考虑,若强碱盐NaA溶液中pH>7,即说明该溶液呈碱性,也就证明A-发生水解,其水解方程式为:A-+H2O
本题难度:一般
2、填空题 (本题共12分)磷是重要的非金属元素。
28.有关白磷(P4)的叙述正确的是 (选填编号)。
a.易溶于CS2 b.易自燃 c.分子中有4个P-P键
P4在过量的热NaOH溶液中会生成PH3气体和NaH2PO2(次磷酸钠),写出该反应的化学方程式 。
由该反应可推知H3PO2为 元酸。用NaH2PO2来验证次磷酸是弱酸,还需要的物质是 。
29.NaH2PO2可在酸性条件下与Ni2+作用进行“化学镀镍”(如在木材表面生成一层Ni-P合金),反应中磷元素化合价发生的变化是 (选填编号)。
a.升高 b.降低 c.既升高又降低
30.25℃时,HF的Ki =" 3.6×10"
参考答案:
本题解析:
本题难度:一般
3、选择题 已知相同温度下电离常数Ki(HF)>Ki(HCN)。在物质的量浓度均为0.1mol/L的NaCN和NaF混合溶液中,下列关系正确的是
A.c(F-)>c(OH-)>c(HCN)>c(HF)
B.c(F-)+c(HF)>c(CN-)+ c(HCN)
C.c(OH-)>c(F-)>c(CN-)>c(H+)
D.c(OH-)>c(HF)>c(HCN)>c(H+)
参考答案:A
本题解析:由于电离常数Ki(HF)>Ki(HCN),根据越弱越水解可知,c(HCN)>c(HF),排除D
再有:CN-+H2O HCN+OH-? F-++H2O<=HF+OH-? H2O
HCN+OH-? F-++H2O<=HF+OH-? H2O H++OH-
H++OH-
可知:c(OH-)>c(HCN)>c(HF)
在盐溶液中,阴、阳离子为主要离子,故c(F-)>c(OH-)>c(HCN)>c(HF),选项A正确,排除C
根据物料守恒可知:c(Na+)=c(F-)+c(HF)=c(CN-)+ c(HCN),排除B
本题难度:困难
4、选择题 在0.1 mol/L氨水中,分别加入少量下列物质,溶液中的c(OH-)增大的是
A.加少量HNO3
B.加少量KOH固体
C.加少量(NH4)2SO4固体
D.加大量水
参考答案:B
本题解析:氨水中存在平衡:NH3+H2O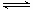 NH3·H2O
NH3·H2O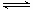 NH4++OH-,加少量硝酸,氢离子与氢氧根离子结合成水,氢氧根离子浓度减小,A错误;加少量氢氧化钾固体,氢氧根离子浓度增大,B正确;加硫酸铵固体,铵根离子浓度增大,平衡向左移动,氢氧根离子浓度减小,C错误;加大量水,促进电离,氢氧根离子物质的量增大,但溶液体积增大,氢氧根离子浓度减小,D错误。
NH4++OH-,加少量硝酸,氢离子与氢氧根离子结合成水,氢氧根离子浓度减小,A错误;加少量氢氧化钾固体,氢氧根离子浓度增大,B正确;加硫酸铵固体,铵根离子浓度增大,平衡向左移动,氢氧根离子浓度减小,C错误;加大量水,促进电离,氢氧根离子物质的量增大,但溶液体积增大,氢氧根离子浓度减小,D错误。
点评:加水促进氨水电离,氢氧根离子物质的量增大但溶液体积增大是主要因素,氢氧根离子物质的量浓度减小。
本题难度:一般
5、选择题 已知0.1?mol/L的醋酸溶液中存在电离平衡:CH3COOH? CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
[? ]
A.加少量烧碱溶液?
B.升高温度
C.加少量冰醋酸?
D.加水
参考答案:BD
本题解析:
本题难度:一般