微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 缓冲溶液可以抗御少量酸碱对溶液pH的影响,Na2HPO4/Na3PO4的混合溶液可以将体系的pH稳定在11.3~13.3之间,是一种常用的缓冲溶液.下列有关该缓冲溶液的说法错误的是( )
A.加入少量强碱,发生反应HPO42-+OH-=PO43-+H2O
B.加入少量强酸,发生反应HPO42-+H+=H2PO4-
C.c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)
D.c(Na+)/2>c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)>c(Na+)/3
参考答案:A、当加入少量碱时,溶液中氢氧根离子和HPO42-发生中和反应生成PO43-,故A正确;
B、当加入少量酸时,发生的反应为PO43-+H+=HPO42-,故B错误;
C、溶液呈电中性,即阴阳离子所带电荷总数相等,所以c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-),故C正确;
D、只要Na2HPO4/Na3PO4的量一定,溶液中所有的含有P原子的微粒之和为一定值,当溶质为Na2HPO4时,C(Na+):[c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)]=2;当溶质为Na3PO4,C(Na+):[c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)]=3,所以Na2HPO4/Na3PO4的混合溶液中12C(Na+)>c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)>13c(Na+),故D正确.
故选B.
本题解析:
本题难度:简单
2、选择题 (10分)pH相等且等体积的醋酸和盐酸与足量的Zn反应,产生H2起始速率醋酸?盐酸(填>,<或=),整个反应过程产生H2的平均反应速率醋酸?盐酸(填>,<或=),放出的H2醋酸?盐酸(填>,<或=);物质的量浓度相等,且等体积的醋酸和盐酸与足量的Zn反应,产生H2起始速率醋酸?盐酸,放出H2的物质的量醋酸?盐酸。
参考答案:=;>;>;<;=。(每空2分)
本题解析:反应开始时氢离子浓度是相同的,因此反应速率也是相同的。由于醋酸是弱酸,存在电离平衡,在反应过程中,促进电离,氢离子浓度大于盐酸的,剩余反应速率大。醋酸的浓度大于盐酸的,最终产生的氢气也多。如果起始时醋酸和盐酸的浓度相同、体 积相同,则产生的氢气也相同。但盐酸中氢离子浓度大,反应速率大。
本题难度:一般
3、选择题 用水稀释0.5mol·L—1的醋酸(CH3COOH)溶液,其中随水量的增加而增大的是:
①H+的物质的量? ②C(H+)? ③C(H+)/C( CH3COO—)
④C(CH3COOH)/ C(CH3COO—) ? ⑤C(OH―)
A.①③⑤
B.①④⑤
C.②④
D.③④
参考答案:A
本题解析:CH3COOH在水中是弱电解质,当往0.5mol·L—1的醋酸中加水稀释的时候,它的电离程度增大,平衡向右移动,H+的物质的量增大,但是整体的C(H+)减小,故①增大,②减小;假设CH3COOH在水中电离的平衡常数为K,那么C(CH3COOH)/C(CH3COO—)=C(H+)K,前面知道C(H+)减小,而K是在一定温度下的常数,故C(CH3COOH)/C(CH3COO—)比值将减小,故④减小;由于②④均为减小,所以满足题意的选项只有A项,故A项正确。
点评:本题关键题眼在于分析清楚水量增大带来的影响,是使醋酸电离平衡正移,氢离子和醋酸根离子的物质的量增大。
本题难度:一般
4、选择题 相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
[? ]
A.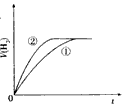
B.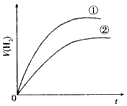
C.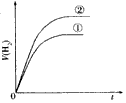
D.
参考答案:C
本题解析:
本题难度:一般
5、选择题 将pH=2的盐酸和pH=2的醋酸溶液分别用蒸馏水稀释相等的倍数,稀释之后两溶液的pH大小
[? ]
A.前者大
B.后者大
C.相等
D.无法确定
参考答案:A
本题解析:
本题难度:一般