微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表:
T℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
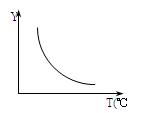
回答下列问题:
(1)该反应正向为ΔH 0;若该反应符合下图所示的关系,则在图中,Y轴是指 。
(2)能判断该反应达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),由此可以判断此时的温度为 ℃。其它条件不变,升高温度,原化学平衡向 反应方向移动(填“正”或“逆” ),容器内混合气体的密度 (填“增大”、“减小”或“不变”),气体平均相对分子质量 (填“增大”、“减小”或“不变”)。
),容器内混合气体的密度 (填“增大”、“减小”或“不变”),气体平均相对分子质量 (填“增大”、“减小”或“不变”)。
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡。若反应开始时CO与H2O的浓度分别为0.200 mol/L和0.100 mol/L,平衡时CO的转化率 。
参考答案:(1)>(1分);CO2或H2的百分含量(1分)(其它合理答案也给分)
(2)b、c (漏选、多选、错选均不得分,2分)
(3)800℃; 正; 不变; 不变(各1分)
(4)33.3%(2分)
本题解析:略
本题难度:一般
2、填空题 (15分)某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧更旺, 因此该同学得出结论“煤炭燃烧时加少量水,可使煤炭燃烧放出更多的热量。”(已知煤炭的燃烧热为-393.15 kJ/mol,氢气的燃烧热为-242 kJ/mol,一氧化碳的燃烧热为-283 kJ/mol)
因此该同学得出结论“煤炭燃烧时加少量水,可使煤炭燃烧放出更多的热量。”(已知煤炭的燃烧热为-393.15 kJ/mol,氢气的燃烧热为-242 kJ/mol,一氧化碳的燃烧热为-283 kJ/mol)
(1)写出该同学看到燃烧现象所涉及到的所有热化学反应方程式;
(2)你认为该同学的结论是否正确,请简要说明理由。
参考答案:(1)C(s) + O2 (g) = CO2(g) △H = -393.15 kJ/mol
H2 (g) + 1/2 O2 (g) = H2O (l) △H = -242 kJ/mol
CO(g) + 1/2 O2 (g) = CO2(g) △H = -283 kJ/mol
C(g) + H2O (l) = CO(g) + H2 (g) △H =" +131.85" kJ/mol
(2)不正确。因为根据盖斯定律,反应过程中的热效应与途径无关,只与反应物和生成物的能量差有关。
本题解析:略
本题难度:一般
3、填空题 (1)0.3 mol气态高能燃料乙硼烷(分子式B2H6),在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,则其热化学方程式为
(2)又已知:H2O(g) =H2O(l) ; ΔH="-44" kJ/mol,则5.6L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是 。
参考答案:B2H6(g)+3O2=B2O3(s)+3H2O(l) ΔH=-2165 kJ/mol 508.25 kJ
本题解析:(1)根据题意可知,1mol气态高能燃料乙硼烷完全燃烧放出的热量是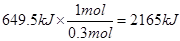 ,所以该反应的热化学方程式为B2H6(g)+3O2=B2O3(s)+3H2O(l) ΔH=-2165 kJ/mol。
,所以该反应的热化学方程式为B2H6(g)+3O2=B2O3(s)+3H2O(l) ΔH=-2165 kJ/mol。
(2)根据盖斯定律可知,乙硼烷完全燃烧生成气态水时热化学方程式是B2H6(g)+3O2=B2O3(s)+3H2O(g) ΔH=-(2165-44×3)kJ/mol=-2033 kJ/mol。5.6L(标准状况)乙硼烷物质的量是0.25mol,所以乙硼烷完全燃烧生成气态水时放出的热量是203 3 kJ/mol×0.25mol=508.25 kJ。
考点:考查热化学方程式的书写以及反应热的有关计算
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练。旨在培养学生的规范答题能力。该题的关键是明确反应热的含义、计算依据以及热化学方程式的书写注意事项,然后结合题意灵活运用即可。
本题难度:一般
4、选择题 如图所示,△H1="-393.5kJ/mol," △H2=-395.4kJ/mol,下列说法或表示式正确的是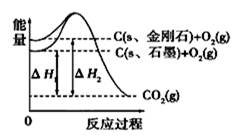
A.石墨和金刚石的转化是物理变化
B.C(s、石墨)=C(s、金刚石) △H="+1.9" kJ/mol
C.金刚石的稳定性强于石墨
D.断裂1mol石墨化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少