微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 实验室需要0.1mol?L-1NaOH溶液450mL和0.5mol?L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是______(填仪器名称).
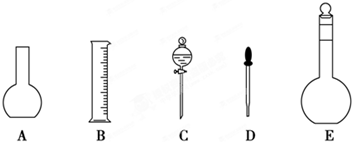
(2)容量瓶不能用于______(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.量取一定体积的液体
F.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol?L-1(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度______0.1mol?L-1.
(4)根据计算得知,所需质量分数为98%、密度为1.84g?cm-3的浓硫酸的体积为______mL(计算结果保留一位小数).如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是______.
参考答案:(1)用容量瓶配制溶液,用胶头滴管定容;还需要用到的仪器有:溶解或稀释药品的烧杯、搅拌或引流用的玻璃棒,
故答案为:AC;烧杯和玻璃棒;
(2)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,故选BCF;
(3)m=CVM=0.1mol/L×0.5L×40g/mol=2.0g,若定容时仰视刻度线,溶液的体积偏大,则所得溶液浓度小于0.1mol?L-1,若NaOH溶液在转移至容量瓶时,洒落了少许,溶质的物质的量偏小,则所得溶液浓度 小于0.1mol?L-1,
故答案为:2.0;小于;小于;
(4)浓硫酸的浓度=C=103ρwM=103×1.84×98%98mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.5/L×0.5L,V=0.0136L=13.6mL,选取的量筒规格应该等于或大于量取溶液体积,故选15mL量筒,稀释浓硫酸的正确操作是:将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌,防止液体溅出,
故答案为:13.6;15;将浓硫酸沿烧杯内壁缓缓倒入水中,并用玻璃棒不断搅拌.
本题解析:
本题难度:一般
2、实验题 (10分)某实验需要用1.0mol·L-1 NaOH 溶液450mL。
配制实验操作步骤有:a.在天平上称量 g NaOH固体放入烧杯中,加水溶解,冷却至室温。b.把制得的溶液小心地注入 中。c.继续向容器中加水至距刻度线1cm~2cm处,改用 加水至刻度线。d.用少量水洗涤烧杯和玻璃棒2~3次。e.将瓶塞塞紧,充分摇匀。填写下列空白:
①操作步骤和正确顺序为 。
②该配制过程中两次用到玻璃棒,其作用分别是 、 。
③在进行b步操作时,不慎有液体溅出,下列处理措施正确的是( )
A.继续进行实验
B.添加部分NaOH溶液
C.倒掉溶液,重新配制
D.倒掉溶液,洗净容量瓶后重新配制