微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知A(g)+B(g)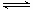 2 C(g)反应的平衡常数和温度的关系如下:
2 C(g)反应的平衡常数和温度的关系如下:
温度/ ℃
| 700
| 800
| 830
| 1000
| 1200
|
平衡常数
| 1.70
| 1.10
| 1.00
| 0.60
| 0.40
|
?
回答下列问题:
(1) 该反应的平衡常数表达式K=______,△H_____0(填“<”“>”“=”);
(2) 容积固定,判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.气体的密度不随时间改变? b. c(A)不随时间改变
c.混合气体平均相对分子质量不随时间改变? d. 压强不随时间改变
(3)1200℃时反应2C(g) 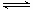 A(g)+B(g)的平衡常数的值为?。
A(g)+B(g)的平衡常数的值为?。
(4)830℃时,向一个10.00 L的密闭容器中充入0.40mol的A和1.60mol的B,如果反应初始2s内生成C的物质的量为0.40mol,则2s内A的平均反应速率v(A)= ____mol·L-1·s-1; 2s时c(B)= ____ mol·L-1; 2s时A的转化率为____;2s时C的体积分数为____。
参考答案:(1) 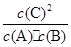 (1分)?<?(1分)
(1分)?<?(1分)
(2)b(1分)
(3)2. 50(1分)
(4)? 0.010 (1分)? 0.14 (1分)? 0.50 (1分)? 20%(1分)
本题解析:(1)温度越高,平衡常数越小,表明升高温度,平衡逆向移动,正向是放热反应。
(2) 容积固定,该反应中反应物和生成物都是气体,质量一定,所以无论平衡与否,该容器内的气体密度都不会随时间改变。反应前后气体的分子数为变,质量一定,因些混合气体的平均相对分子质量不管平衡与否都不随时间改变。分子数在反应前后 不变,因此压强始终不变。
(3)该平衡的平衡常数为题中1200度时的平衡常数的倒数。
(4)依题意可知v(C)= 0.02mol·L-1·s-1;所以v(A)= 0.01mol·L-1·s-1;
A(g)? +? B(g)?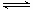 ?2 C(g)
?2 C(g)
起始:? 0.40mol? 1.60mol? 0
转化:? 0.20mol? 0.20mol? 0.40mol
平衡:? 0.20mol? 1.40mol? 0.40mol
C的体积分数也就是C的物质的量分数,为: 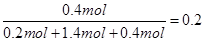
本题难度:一般
2、填空题 (10分)向2 L的密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且4个阶段所改变的外界条件均不相同,已知t3——t4阶段为使用催化剂。观察下图,回答下列问题:
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为 。
(2)乙图中t2时引起平衡移动的条件是 ,t5时引起平衡移动的条件是 。
(3)乙图中表示平衡混合物中,在这4个阶段中C的含量最高的一段时间是 。
(4)该反应的化学方程式可以表示为: ,正反应为 (填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为 。
参考答案:(1) 0.004 mol/Ls (2分)。
(2) 增加A的浓度,升高温度。(3)t5——t6。(每空1分)
(4) 3A(g) B(g)+2C(g),(2分)吸热(1分)
B(g)+2C(g),(2分)吸热(1分)
(5)0.04mol(2分)
本题解析:略
本题难度:一般
3、选择题 工业制取硫酸是一个连续的生产过程。今测得进入接触室时混合气体(396 K、40000 kPa,主要成分为SO2、O2、N2)的流量为1.0 m3/s,从接触室导出气体(792 K、40000 kPa)的流量为1.8 m3 /s。据此,以下说法中正确的是( )
A.SO2的催化氧化反应是吸热反应
B.SO2的转化率一定为20%
C.导出气体中SO3所占的体积分数为2 / 9
D.单位时间内进入接触室的气体与从接触室导出的气体的物质的量之比为9∶10
参考答案:C
本题解析:由阿伏加德罗定律和气体定律知,反应后温度为反应前的两倍,假设反应前为1mol的混合气体,反应后应该为0.9 mol;
2SO2 ?+?O2?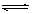 2SO3?△n
2SO3?△n
系数比:0.2 mol? 0.1 mol? 0.2 mol? 0.1 mol
故反应中共生成0.2 molSO3,导出气体中SO3所占的体积分数为2 / 9;由于反应前SO2的量不能确定,故其转化率也无法确定;
本题难度:简单
4、选择题 如图所示,向A中充入1 mol X和1 mol Y,向B中充入2 mol X和2 mol Y,起始VA=VB=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g) 2N(g)+W(g) ΔH>0,达到平衡时,v(A)=1.2aL,则下列说法错误的是
2N(g)+W(g) ΔH>0,达到平衡时,v(A)=1.2aL,则下列说法错误的是
A.反应开始时,B容器中化学反应速率快
B.A容器中X的转化率为40%,且比B中X的转化率小
C.打开K达新平衡后,升高B容器温度,A容器体积会增大
D.打开K一段时间,达到新平衡时,A的体积为2.6aL(两边通管中气体体积不计)
参考答案:B
本题解析:A、起始VA=VB=aL,B中的物质的量大于A中的物质的量,即B装置中的浓度大于A装置中的浓度,所以反应开始时,B反应速率大于A反应速率,A正确;B、等压、等温条件下,气体的体积之比等于气体的物质的量之比,达到平衡时,VA="1.2a" L,所以平衡后混合气体的物质的量是2.4mol.设A物质反应了mmol.
X(g)+Y(g)?2Z(g)+W(g) 物质的量增多
1moL 1moL
m 2.4-2 所以X物质的转化率=(0.4/1) ×100%=40%;B装置是在等容条件下,反应向正反应方向移动时,混合气体的物质的量增大,导致容器内气体压强增大,增大压强能抑制X的转化率,B错误;C.该反应是一个反应前后气体体积增大的吸热反应,升高温度,平衡向正反应方向移动,混合气体的物质的量增大,导致A容器的体积增大,C正确.D、当打开K时,整个装置是在等温、等压条件下反应,使整个装置中气体的压强与A装置中的初始压强相同时,A和B的体积之和为3aL,其中B占aL,则A占2aL;当等温等压条件下反应达到平衡状态时,混合气体的体积是原来的1.2倍,即混合气体的体积是3.6aL,其中B是aL,所以A是2.6aL,D正确;选B。
考点:考查化学平衡的计算。
本题难度:一般
5、选择题 对于可逆反应: ,下列各图中正确的是
,下列各图中正确的是

参考答案:A
本题解析:该反应为放热反应,温度升高平衡向逆反应方向移动,C的质量分数减小,故A正确;根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,故B错误;催化剂同等程度地改变正逆反应速率,平衡不发生移动,故C错误;该反应为放热反应,温度升高平衡向逆反应方向移动,A的转化率降低,根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,故D错误.故选A.
考点:化学平衡的影响因素
本题难度:一般