微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下表是某些原子晶体的熔点和硬度
原子晶体
| 金刚石
| 氮化硼
| 碳化硅
| 石英
| 硅
| 锗
|
熔点/℃
| 3 900
| 3 000
| 2 700
| 1 710
| 1 410
| 1 211
|
硬度
| 10
| 9.5
| 9.5
| 7
| 6.5
| 6.0
|
?
分析表中的数据,判断下列叙述正确的是(?)。
①构成原子晶体的原子种类越多,晶体的熔点越高
②构成原子晶体的原子间的共价键键能越大,晶体的熔点越高
③构成原子晶体的原子的半径越大,晶体的硬度越大
④构成原子晶体的原子的半径越小,晶体的硬度越大
A.①②? B.③④? C.①③? D.②④
参考答案:D
本题解析:原子晶体的熔点和硬度与构成原子晶体的原子间的共价键键能有关,而原子间的共价键键能与原子半径的大小有关。
本题难度:一般
2、填空题 (12分)一般地,晶体类型不同,其结构和性质也不同。
⑴下表是四种同主族元素的氧化物的离子晶体晶格能数据。
氧化物
| MgO
| CaO
| SrO
| BaO
|
晶格能/ kJ·mol-1
| 3791
| 3410
| 3223
| 3054
|
①将上表中四种氧化物的共熔物冷却,首先析出的是? ▲?。
②碳酸盐的热分解示意图如下图。两种碳酸盐的热分解温度CaCO3? ▲?SrCO3(填“高于”或“低于”)

⑵已知NH3·H2O的电离方程式为NH3·H2O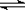 NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
①2NH3·H2O的晶体类型为? ▲?。
②NH3极易溶于水,其主要原因是? ▲?。
⑶CaF2的晶体结构如图所示。
①CaF2晶体中钙离子的配位数是? ▲?。
②一个CaF2晶胞中包含? ▲?个钙离子。
参考答案:⑴①BaO? ②高于
⑵①分子晶体? ②NH3与H2O形成分子间氢键
⑶①8? ②4(每空2分,共12分)
本题解析:略
本题难度:简单
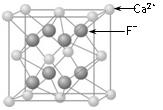
3、简答题 (1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体.?NiO(氧化镍〕晶体的结构与NaQ相同,Ni2+与最邻近O2-的核间距离为a10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g.mol-1).
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代.其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.某氧化镍样品组成为Nio970,试计算该晶体中Ni3+与Ni2+的离子数之比.
参考答案:(1)1cm3中阴、阳离子总数=(1.00cma10-8cm)3;
1cm3中?Ni2+-O2-离子对数=(1.00cma×10-8cm)3×12
密度=mV=(1.00cma×10-8cm)×74.7g/mol×126.02×1023/mol=62.0a3g/(cm)3
答:NiO晶体的密度为62.0a3g/(cm)3;
(2)设1mol Ni0.97O中含Ni3+xmol,Ni2+为(0.97-x)mol,根据晶体仍呈中性,可知? 3x+2×(0.97-x)=2×1,
x=0.06mol? Ni2+为(0.97-x)mol=0.91mol,即离子数之比 Ni3+:Ni2+=0.06:0.91=6:91,
答:晶体中Ni3+与Ni2+的离子数之比为6:91.
本题解析:
本题难度:一般
4、选择题 下列化合物沸点比较错误的是( )
A.丙烷>乙烷>甲烷
B.正戊烷>异戊烷>新戊烷
C.邻二甲苯>甲苯>苯
D.对二甲苯>邻二甲苯>间二甲苯
参考答案:A.烷烃的相对分子质量越大,沸点越高,则丙烷>乙烷>甲烷,故A正确;
B.同分异构体中,支链越多,沸点越低,则正戊烷>异戊烷>新戊烷,故B正确;
C.芳香烃中相对分子质量越大,沸点越高,则邻二甲苯>甲苯>苯,故C正确;
D.对二甲苯极性最小,沸点最低,沸点为对二甲苯<邻二甲苯<间二甲苯,故D错误;
故选D.
本题解析:
本题难度:简单
5、选择题 石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子中,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,平面结构如图所示.则x值为( )
A.8
B.12
C.24
D.60
