微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中正确的是
A.同体积同浓度的盐酸和醋酸与足量锌反应,开始时,盐酸反应速率快
B.同体积同浓度的盐酸和醋酸与足量锌反应,盐酸放出的H2多
C.PH值相同的盐酸和醋酸,两者的物质的量相同
D.盐酸和醋酸与锌反应的离子方程式完全相同
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列物质中,属于电解质的是
A.CaCO3
B.蔗糖
C.食盐水
D.空气
参考答案:A
本题解析:分析:电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;而非电解质是指:在熔融状态和水溶液中都不能导电的化合物.也就是说,非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子.据此即可解答.
解答:A.碳酸钙在水溶液里或在熔融状态下,能电离出自由移动的钙离子和碳酸根离子,导致导电来源:91考试网 91ExAm.org,所以碳酸钙是电解质,故A正确;
B.蔗糖是化合物,在水溶液中和熔融状态下只存在蔗糖分子,没有自由移动的离子,所以不能导电,是非电解质,故B错误;
C.NaCl溶液能导电,但它是混合物,既不是电解质,也不是非电解质,故C错误;
D.空气是由氧气和氮气组成的混合物,既不是电解质,也不是非电解质,故D错误;
故选A.
点评:本题重点考查了电解质概念的辨析,解题时紧抓住电解质必须是化合物,单质和混合物既不是电解质也不是非电解质,题目较简单
本题难度:简单
3、选择题 下列各组物质,前者为强电解质,后者为弱电解质的是
[? ]
A.食盐、浓氨水
B.苛性钠、硫化氢
C.硫酸、硫酸钡
D.三氧化硫、二氧化硫
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列离子万程式书写正确的是
A.将金属钠投入水中:
B.过量CO2通入Ca(ClO)2溶液中:
C.向Na2CO3溶液中加入过量CH3COOH溶液:
D.向Ba(OH)2溶液中加入少量NaHSO3溶液:
参考答案:B
本题解析:分析:A.没有配平;
B.反应生成碳酸氢钙和HClO;
C.醋酸在离子反应中保留化学式;
D.NaHSO3完全反应,反应生成亚硫酸钡、水、NaOH.
解答:A.将金属钠投入水中的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.过量CO2通入Ca(ClO)2溶液中的离子反应为ClO-+CO2+H2O═HCO3-+HClO,故B正确;
C.向Na2CO3溶液中加入过量CH3COOH溶液的离子反应为CO32-+2HAc═CO2+H2O+2Ac-,故C错误;
D.向Ba(OH)2溶液中加入少量NaHSO3的离子反应为OH-+HSO3-+Ba2+=BaSO3↓+H2O,故D错误;
故选B.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意与量有关的离子反应为解答的难点,题目难度不大.
本题难度:困难
5、简答题 海水是一种丰富的资源,工业上从海水中可提取NaCl、Na2CO3、Mg等多种物质,这些物质广泛应用于生产、生活等领域.如图所示是某工厂对海水资源进行综合利用的流程.
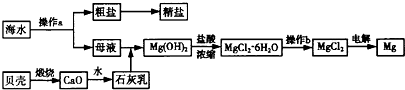
请回答下列问题:
(1)流程图中操作a的名称为______.
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱.
①气体A应是______(填化学式),此过程的化学方程式为______.
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上常向滤液D中通入NH3,并加入细小食盐颗粒,使溶液冷却,析出不含有NaHCO3副产品的NH4Cl晶体,通入NH3的作用是______.
(3)操作b应在______气流中进行,若在空气中加热,则会水解生成Mg(OH)Cl,写出有关反应的化学方程式:______.
(4)某氯碱厂每天消耗234吨NaCl,可生产质量分数为32%的烧碱溶液______吨.
参考答案:(1)由流程图可知是从海水中分离出粗盐,即从溶液中分离出溶质,故用蒸发结晶的方法,故答案为:蒸发结晶;
(2)①向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,上述反应的化学方程式分别为NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓,故答案为:NH3;2NaHCO3Na2CO3+CO2↑+H2O;
②根据氨气溶于水后生成氨水,氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来分析,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度,
故答案为:增大NH4+的浓度有利于氯化铵的析出来,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;
(3)如果直接在空气中加热MgCl2?6H2O则Mg2+会水解的生成Mg(OH)Cl和HCl,通入HCl可以抑制其水解;其反应方程式为:MgCl2?6H2O?△?.?Mg(OH)Cl+HCl↑+5H2O
故答案为:HCl;MgCl2?6H2O?△?.?Mg(OH)Cl+HCl↑+5H2O;
(4)由NaCl溶液制备NaOH溶液,其方程式为:2NaCl+2H2O?通电?.? 2NaOH+H2↑+Cl2↑,根据Na元素守恒
? NaCl~NaOH
? 58.5?40?
? 234t?m×32%
解得:m=500t,故答案为:500.
本题解析:
本题难度:一般