微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列状态的物质,既能导电又属于电解质的是
A.KCl溶液
B.液态HCl
C.熔融的NaOH
D.蔗糖溶液
参考答案:C
本题解析:A.KCl溶液能导电,是混合物;B.液态HCl是电解质,但不能导电;C.熔融的NaOH 能导电,是电解质;D.蔗糖溶液不能导电,是非电解质。
本题难度:一般
2、选择题 下列电离方程式错误的是
A.K2CO3=2K++CO32-
B.NaOH=Na++OH-
C.KClO3=K++Cl-+3O2-
D.NH4Cl=NH4++Cl-
参考答案:C
本题解析:分析:强电解质的电离用“═”,遵循质量守恒定律和电荷守恒,并注意原子团不可拆分,以此来解答.
解答:A.K2CO3为强电解质,电离方程式为K2CO3=2K++CO32-,故A正确;
B.NaOH为强电解质,电离方程式为NaOH=Na++OH-,故B正确;
C.KClO3为强电解质,电离方程式为KClO3=K++ClO3-,故C错误;
D.NH4Cl为强电解质,电离方程式为NH4Cl=NH4++Cl-,故D正确;
故选C.
点评:本题考查电离方程式的书写,明确电解质的强弱及电离方程式遵循电荷守恒及质量守恒定律即可解答,易错点为学生忽略物质中的原子团.
本题难度:一般
3、选择题 常温下,下列有关叙述正确的是( )
A.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol?L-1
B.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
C.pH相等的①NH4C1、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①=②>③
D.10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V?(总)=20mL导电能力加水体积
参考答案:解;A、根据NaB溶液的pH=8可知,在溶液中存在c(Na+)+c(H+)=c(OH-)+c(B-),c(Na+)-c(B-)=c(OH-)-c(H+)=10-6moL/L-10-8mol/L=9.9×10-7mol/L,故A正确;
B、在Na2CO3中,Na离子与C原子的比值为2:1,根据物料守恒可知,c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B错误;
C、pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,NH4HSO4电离出H+,NH4+浓度最小,NH4Cl和(NH4)2SO4水解程度相同,正确顺序为①=②>③,故C正确;
D、10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,如HA为强酸,则V(总)=20mL,如HA为弱酸,则V(总)<20mL,所以所得溶液体积V(总)≤20mL,故D错误.
故选AC.
本题解析:
本题难度:一般
4、选择题 在H2SO4和Al2 (SO4)3的混合溶液中,铝离子浓度是0.4 mol / L,硫酸根离子浓度是0.7 mol / L,则氢离子浓度约是?(?)
A.0.1 mol / L
B.0.2 mol / L
C.0.3 mol / L
D.0.4 mol / L
参考答案:B
本题解析:由溶液呈中性即溶液中阳离子所带电荷总数=阴离子所带电荷总数可知:
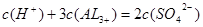 ,即
,即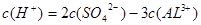 ,得
,得
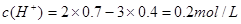
本题难度:一般
5、选择题 下列物质,只能在水溶液中发生电离的是
A.NaCl
B.C2H5OH
C.HNO3
D.KOH
参考答案:C
本题解析:略
本题难度:简单