|
高考化学知识点总结《物质的组成》考点预测(2017年强化版)(二)
2017-08-01 02:12:29
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
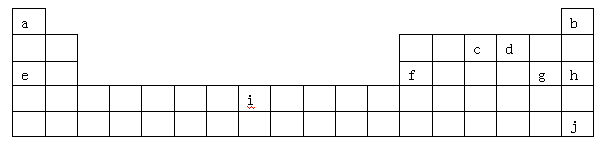
(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图__________。
(2)由以上元素形成的金属单质中,熔点最低的是__? __。(填元素符号)
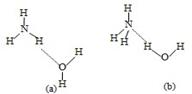
(3)NH3·H2O的电离方程式为NH3·H2O NH4++OH-,试判断NH3溶于水后,右图中形成的NH3·H2O的合理结构是________(填序号)。 NH4++OH-,试判断NH3溶于水后,右图中形成的NH3·H2O的合理结构是________(填序号)。
(4)a位于第ⅠA族,有人认为a也可以放在ⅦA族,下列物质能支持这种观点的是?
A.HF
B.H3O+
C.NaH
D.H2O2
| (5)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是_________(填写字母)。
(6)利用稀有气体化合物,人们实现了许多制备实验上的突破。如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe。写出该反应的方程式:
?
参考答案:(1)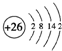 (2)e? (3)(b)? (4)C? (5)j (6) (2)e? (3)(b)? (4)C? (5)j (6) 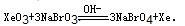
本题解析:根据元素在周期表中的分布,可以知道:a是H,b是He,c是N,d是O,e是Na,f是Al,g是Cl,h是Ar,i是Fe,j是Xe.
(1)Fe是26号元素,原子结构示意图为: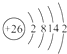 ,故答案为: ,故答案为: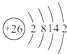 ; ;
(2)钠和铝中,熔点最低的是Na,故答案为:Na;
(3)NH3溶于水后,形成的NH3?H2O中,根据NH3?H2O的电离方程式为NH3?H2O NH4++OH-,可知结构中含有铵根和氢氧根的基本结构,故答案为:(b); NH4++OH-,可知结构中含有铵根和氢氧根的基本结构,故答案为:(b);
(4)因首先被用来与F2反应制备稀有气体化合物的元素的性质最活泼,而稀有气体化学性质相对稳定,从上至下,稀有气体元素金属性增强,相对来说易失去电子,所以最先制得j的氟化合物,故答案为:j;
(5)根据信息可知:反应物有XeO3和NaBrO3,生成物有NaBrO4和Xe,结合氧化还原电子得失配平可知:XeO3+3NaBrO3═3NaBrO4+Xe,故答案为:XeO3+3NaBrO3═3NaBrO4+Xe↑;
(6)氯化氢是含有H-Cl共价键的共价化合物,故答案为:共价.
点评:本题考查学生元素周期表中的基本知识,题目设置难度较高,综合性较强。
本题难度:一般
2、选择题 下列表达正确的是(?)
A.氧族元素包括氧、硫、锡、碲、钋
B.Na2O2固体中的阳离子和阴离子个数比为1:1
C.H、D、T、H+可以用来表示氢元素的四种同位素
D.表示金属元素名称的汉字不一定都含“钅”旁
参考答案:D
本题解析:(易)考查常见元素的名称、符号、离子符号的书写,氧族元素包括氧、硫、硒、碲、钋,注意硒与锡元素的名称的区别。Na2O2固体中的阳离子是Na+,阴离子是O22-(过氧根),阳离子和阴离子个数比为2:1。H、D、T表示氢的同位素,H+表示氢离子,可以说成:H、D、T、H+可以用来表示氢元素的四种不同微粒。元素名称的中文书写的特点:金属元素除金、汞外,其他都是“钅”旁。
本题难度:简单
3、计算题 用于金属焊接的某种焊条,其药皮由大理石、水泥、硅、铁、铝等配制而成。试回答:
(1)30Si的原子的中子数为________。
(2)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则n=________。
(3)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是________。
(4)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为________。(只写结果)
参考答案:(1) 16 (1分)? (2)n=1?(1分)
(3) CO2(2分)? (4)25% ?(3分)
本题解析:(1)在原子符合的表达式中左上角表示质量数,左下角表示质子数,根据质量数=质子数+中子数可计算出30Si的原子的中子数为:30-14=16。
(2)在元素周期表中只有第 ⅦA族卤素原子的氢化物的水溶液才均显酸性,因为Al3+与Yn-的电子数相同,所以Y是F元素。所以n=1。
(3)由药皮的成分大理石、水泥、硅、铁、铝等可知,在高温下只有大理石才分解产生CO2,因此气体只能是CO2气体。
(4)熔渣中只有SiO2与盐酸不反应,因此11.0g是SiO2的质量。Fe2O3、Al2O3溶于盐酸分别生成FeCl3、AlCl3,当滤液中加入过量NaOH溶液时AlCl3生成NaAlO2,FeCl3生成Fe(OH)3沉淀。所以21.4g固体是Fe(OH)3的质量,其物质的量为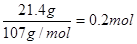 ?,由铁原子守恒知Fe2O3的物质的量为0.1mol,其质量为0.1mol×160g?mol-1=16.0g。熔渣中Al2O3的质量分数为 ?,由铁原子守恒知Fe2O3的物质的量为0.1mol,其质量为0.1mol×160g?mol-1=16.0g。熔渣中Al2O3的质量分数为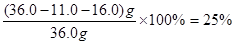 ?。 ?。
点评:本题考查元素周期表的排布规律和化学计算,综合性较强,题目难度较大。
本题难度:一般
4、选择题 含硒(Se)的保健品已开始进入市场。已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是
A.非金属性比硫强
B.氢化物比HBr稳定
C.原子序数为34
D.最高价氧化物的水化物显碱性
参考答案:C
本题解析:同周期,非金属性从上到下逐渐减弱,故非金属性比硫的弱,气态氢化物的稳定性逐渐减弱,故A、B均错误;由硫的原子序数可推出硒的原子序数为34,故C正确;D、硒为非金属,故最高价氧化物的水化物呈酸性,D错误;故选C。
本题难度:简单
5、选择题 在d轨道中电子排布成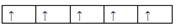 ,而不排成 ,而不排成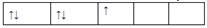 最直接的根据是? (? ) 最直接的根据是? (? )
A.能量最低原理
B.泡利不相容原理
C.洪特规则的特例
D.洪特规则
参考答案:D
本题解析:洪特规则是在同一亚层中的电子尽可能分占不同轨道,而且自旋方向相同。
本题难度:一般
|