微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将质量分数为a%和质量分数为5a%的氨水等体积混合后,混合溶液中氨的质量分数是
A.3a%
B.6a%
C.>3a%
D.<3a%
参考答案:D
本题解析:设质量分数为a%、5a%的氨水溶液的密度分别为ρ1、ρ2(单位g/mL),各取V mL,混合溶液里NH3的质量分数为x%.
根据溶液稀释定律得:ρ1Va%+ρ2V5a%=(ρ1V+ρ2V)×x%
化简得:x=(ρ1+5ρ2)a/(ρ1+ρ2)
将上式整理得:x=[1+4ρ2/(ρ1+ρ2)]a
因为ρ[NH3(aq)]<1 g/mL,并且ω(NH3·H2O)越大ρ[NH3(aq)]越小.
所以ρ2<ρ1,ρ1+ρ2>2ρ2.则[1+4ρ2/(ρ1+ρ2)]a<3a,即x<3a.
本题难度:一般
2、选择题 用溶质质量分数为98%(密度为1.84 g?cm-3)的浓硫酸来配制质量分数为49%的硫酸,试确定取用的浓硫酸与水的体积比
A.小于1
B.等于1
C.大于1
D.无法确定
参考答案:A
本题解析:方法1(常规法):设浓硫酸的体积为100 mL,则其质量为100 mL×1.84 g?cm-3=184 g。根据稀释前后溶质的质量不变的原则,稀释之后溶液的质量为:184 g×98%÷49%=368 g。不难看出,需水的质量为368 g-184 g=184 g,需水的体积为184 g÷1 g?cm-3=184 mL。取用的浓硫酸与水的体积比为:100 mL∶184 mL=1∶1.84。
方法2(推理法):由于质量有加和性,所以当98%的浓硫酸与水等质量混合时,混合后的质量分数为49%,符合要求。考虑到浓硫酸密度大于水的密度,因此浓硫酸与水的体积比小于1。
本题难度:简单
3、选择题 如果假设12C的相对原子质量为24,且以0.024?千克12C所含有的原子数为阿伏加德罗常数,则下列数值中肯定不会因此而改变的是
A.气体摩尔体积
B.标准状况下氧气的密度
C.Cl2的相对分子质量
D.一定质量硫酸中氧原子的物质的量
参考答案:B
本题解析:分析:根据假设12C的相对原子质量为24,且以0.024?千克12C所含有的原子数为阿伏加德罗常数,则在规定12C的相对原子质量为24时,实际上是把作为相对原子质量的标准从原来用12C质量的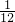 ,改为
,改为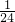 ,但是单个碳原子的质量并没有因此而发生改变;
,但是单个碳原子的质量并没有因此而发生改变;
又原来是以0.012kg12C所含有的碳原子数作为阿伏加德罗常数(即6.02×1023),现在用0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),很明显0.024kg12C中所含的原子个数是0.012kg12C中所含的原子个数的2倍;故阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍(即2×6.02×1023),以此来解答.
解答:由假设12C的相对原子质量为24,且以0.024?千克12C所含有的原子数为阿伏加德罗常数,则阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍(即2×6.02×1023),
A、气体摩尔体积是单位物质的量的气体所占的体积,阿伏伽德罗常数变大,则物质的量变了,即气体摩尔体积也变化了,故A错误;
B、标准状况下氧气的密度由摩尔质量、摩尔体积来决定,阿伏伽德罗常数变大,摩尔质量和摩尔体积变大的倍数相同,即氧气的密度不变,故B正确;
C、因相对原子质量的标准变化,则相对分子质量发生变化,故C错误;
D、一定质量硫酸中氧原子的物质的量为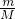 ×4,阿伏伽德罗常数变大摩尔质量也变大,则氧原子的物质的量变小,故D错误;
×4,阿伏伽德罗常数变大摩尔质量也变大,则氧原子的物质的量变小,故D错误;
故选B.
点评:本题考查阿伏伽德罗常数,明确常数的规定发生变化时其数值的变化是解答本题的关键,并熟悉摩尔质量、摩尔体积等概念来解答.
本题难度:一般
4、选择题 已知3.2?g某气体中含有3.01×1022个分子,此气体的摩尔质量是
A.32 g/mol
B.64
C.64 g/mol
D.4 g
参考答案:C
本题解析:根据n=N÷NA,所以n=3.01×1022÷6.02×1023 mol-1="0.05" mol?再由M=m÷n=3.2g÷0.05 mol=64g/mol。
本题难度:简单
5、选择题 下列叙述正确的是
A.2mol?H2O的质量为36g?mol-1
B.3.01×1023个SO2分子的质量为32g
C.NH3的摩尔质量为17g
D.标况下,1?mol任何物质体积约为22.4L
参考答案:B
本题解析:分析:A.2mol水的质量为36g;
B.3.01×1023个SO2分子的物质的量为0.5mol,根据m=nM计算质量;
C.NH3的摩尔质量为17g/mol;
D.标况下,1?mol任何气体所占体积约为22.4L.
解答:A.g/mol是摩尔质量的单位,2mol水的质量为36g,故A错误;
B.3.01×1023个SO2分子的物质的量为0.5mol,其质量=0.5mol×64g/mol=32g,故B正确;
C.NH3的摩尔质量为17g/mol,1mol氨气的质量为17g,故C错误;
D.标况下,物质不一定都是气体,标况下,1?mol任何气体所占体积约为22.4L,故D错误;
故选B.
点评:本题考查摩尔质量、气体摩尔体积、常用化学计量计算等,比较基础,注意气体摩尔体积的使用条件与对象.
本题难度:一般