微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn ③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是______________________。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的_____________形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是______________。
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙?
(4) Q、R、Y三种元素的第一电离能数值由小到大的顺序为____________________。 (用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为__________________。
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于_________________________。
参考答案:(1)1s22s22p63s23p63d9?
(2)孤对电子(孤电子对)
(3)b?
(4)Si < C
(5)3:2
(6)原子晶体
本题解析:
本题难度:一般
2、选择题 有下列电子排布式的原子中,第一电离能最小的是
A.ns2np3
B.ns2np4
C.ns2np5
D.ns2np6
参考答案:B
本题解析:每个周期的第一种元素第一电离能最小,最后一种元素(稀有气体)的第一电离能最大。但是有反常电离能半充满和全空比较稳定,比如第二周期的O<N。第三周期的Mg>Al,P>S.
本题难度:简单
3、选择题 下列有关电子云和原子轨道的说法正确的是
A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云
B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动
C.p能级的原子轨道呈纺锤形,随着电子层的增加,p能级原子轨道也在增多
D.与s原子轨道的电子相同,p原子轨道电子的平均能量随能层的增大而增加
参考答案:D
本题解析:试题分析:电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述,电子云实际上不存在的,A不正确;B不正确,电子在核外电子空间的运动状态是不固定的;p能级原子轨道只有3个,C不正确,所以正确的答案选D。
考点:考查电子云和原子轨道的有关正误判断
点评:该题是常识性知识的考查,试题贴近教材,基础性强,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于激发学生的学习兴趣和学习积极性。
本题难度:困难
4、简答题 下表是元素周期表的一部分.
族
周期 | | II?A | | IV?A | | | VII?A
1
① |
2
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
(11)
|
(1)表中所列元素中,最稳定的气态氢化物的化学式______,原子半径最小的元素的元素符号是______.
(2)某元素原子的核外M层电子数是元素②最外层电子数的1/2,则该元素的元素符号是______,其元素原子结构示意图为______.
(3)某元素是组成蛋白质的重要成分,蛋白质又是生命的存在形式,因此此元素被称为“生命元素”,此元素的名称为______,其单质的电子式为______,用化学方程式表示其单质的一种重要的工业用途:______.
(4)④与⑥形成原子个数之比为1:1的化合物的电子式为______,用电子式表示⑤和⑩形成化合物的过程______
(5)写出下列化学方程式
⑤的单质通入⑥和⑨形成化合物的水溶液中______
⑨的单质通入⑥和(11)形成化合物的水溶液中______.
参考答案:根据元素在周期表中的分布,可以推知①是H,②是C,③是N,④是O,⑤是F,⑥是Na,⑦是Al,⑧是S,⑨是Cl,⑩是Ca,(11)是Br.
(1)在周期表中,从左到右的电子能力逐渐增强,从上到下得电子能力逐渐减弱,得电子能力最强的是F,原子半径最小的是H,所以HF是最稳定的氢化物,故答案为:HF;H;
(2)原子的核外M层电子数是C元素最外层电子数的1/2即核外电子排布分别是2、8、2,应为Mg,原子结构示意图为:
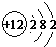
,故答案为:Mg;
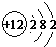
;
(3)氮元素被称为“生命元素”,氮气中含有氮氮三键,电子式为:

,在工业生可以用氮气和氢气来合成氨,即?N2+3H2高温高压
本题解析:
本题难度:一般
5、选择题 同一主族的两种元豢的原子序数之差不可能是
[? ]
A.16
B.26
C.36
D.46
参考答案:D
本题解析:
本题难度:简单