微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 下列叙述正确的是( )
A.所有的主族元素的简单离子的化合价与其族序数不相等
B.现已发现的零族元素的单质在常温常压下都是气体
C.ⅥA族元素的原子,其半径越大,越容易得到电子
D.同周期元素中,ⅦA族元素的原子半径最大
参考答案:A、主族元素的简单阳离子的化合价与其族序数相等,而阴离子不等,故项错误;
B、族元素的单质在常温常压下都是气体,称为稀有气体,故B正确;
C、ⅥA族元素的原子半径从上到下逐渐增大,非金属性减弱,金属性增强,即得电子能力减弱,而失电子能力增强,故C项错误;
D、同周期元素从左至右原子半径逐渐减小,故D项错误.
故选B.
本题解析:
本题难度:一般
2、选择题 短周期元素X和Y,X位于Y的前一周期,其原子最外电子层只有一个电子,Y原子的次外层电子数是最外层电子数的1/3,则X和Y形成的化合物的化学式可表示为:
A.X2Y3
B.X3Y
C.XY2
D.X2Y
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列关于元素周期律的叙述正确的是
A.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现
B.元素的性质随着原子序数的递增而呈周期性的变化
C.随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现
D.元素性质的周期性变化是指原子核外电子排布的周期性变化,原子半径的周期性变化及元素主要化合价的周期性变化
参考答案:B
本题解析:随着元素原子序数的递增,原子最外层电子数K层从1到2;随着元素原子序数的递增,元素的最高正价从+1到+7,负价从-4到-1重复出现;元素的金属性和电负性等也是元素的性质,也会出现周期性的变化.
本题难度:简单
4、填空题 M、N、X、Y四种主族元素在周期表里的相对位置如下表所示,已知它们的原子序数总和为46。
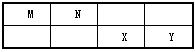
(1)M与Y形成的化合物中含______键,属______分子(填“极性”或“非极性”)。
(2)N元素形成的单质分子中的化学键类型及数目是____________。在化学反应中_______(填“σ键”或“π键”)易断裂。
(3)由N、Y的氢化物相互作用所生成的物质的电子式为_______________。其中的化学键有__________。
(4)写出M单质与X元素最高价氧化物对应的水化物反应的化学方程式:__________________
(5)核电荷数比X元素少8的元素可形成多种粒子,按要求填入空格中

参考答案:(1)极性;非极性
(2)一个σ键、两个π键;π键
(3)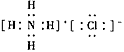 ;离子键、共价键、配位键
;离子键、共价键、配位键
(4)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(5)O2;O2-;O22-
本题解析:
本题难度:一般
5、选择题 实际存在的11H、12H、13H、H+和H2,它们是( )
A.氢的五种同位素
B.五种氢元素
C.氢的五种核素
D.氢元素的五种不同微粒
参考答案:A、同位素是原子而言的,H2为单质,故A错误;
B、元素为质子数相同中子数不同一类原子的总称,是氢元素的形成不同微粒,故B错误.
C、核素是指具体的原子,H2为单质,故C错误.
D、是氢元素的形成不同微粒,故D正确.
故选:D
本题解析:
本题难度:简单