微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
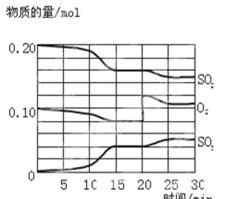
1、填空题 (6分)一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
回答下列问题:
(1) 若降低温度,该反应的化学平衡常数 。(填“增大”“减小”或“不变”)
(2)该反应处于平衡状态的时间段为 。
(3)反应进行至20 min时,曲线发生变化的原因是 (用文字表达)。10 min到15 min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
(4)维持容器体积不变,向该反应的平衡体系中充入氮气 , 则平衡 ( 填“向左”或“向右”或“不”)移动;维持容器体积不变,向该反应的平衡体系中移走部分混合气体 , 则平衡 ( 填“向左”或“向右”或“不”) 移动。
参考答案:(每空1分,共6分)
(1)增大;(2)15-20min,25-30min;(3)增大氧气的浓度,a、b;(4)不、向左
本题解析:(1)正反应是放热反应,所以降低温度,平衡向正反应方向进行,则平衡常数增大。
(2)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以根据图像可知,处于平衡状态的是15~20min,25~30min。
(3)反应进行至20 min时,氧气的浓度突然增大,而SO2的浓度逐渐减小,三氧化硫的浓度逐渐增大,所以改变的条件是增大氧气的浓度;根据图像可知,10 min到15 min时,物质的浓度变化量增大,即反应速率加快,所以改变的条件是使用了催化剂或改变了压强,答案选ab。
(4)条件不变,充入氮气,压强增大,但浓度是不变的,所以平衡不移动。维持容器体积不变,向该反应的平衡体系中移走部分混合气体,相当于降低压强,平衡向逆反应方向进行。
本题难度:困难
2、填空题 (9分)合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g) 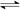 2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1
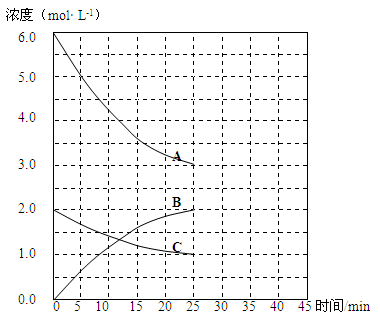
T1℃时,在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示:
请回答:
(1)若反应起始时n(N2)为1mol、n(H2)为3mol,则反应达到平衡时,放出的热量 (填“=”或“<”或“>”)92 kJ
(2)表示N2浓度变化的曲线是 (填浓度变化曲线代号“A”或“B”或“C”)。
(3)用H2浓度的变化表示该反应在0~25min末的速率是 mol·L-1·min-1。
(4)若该反应在一定条件下于25 min末达到平衡状态,则
①此时平衡常数K = 。
②保持该反应条件不变至第30 min末,将温度由T1℃升高到T2℃,则反应在第40min末再次达到平衡,在此过程中H2浓度变化了1.5 mol·L-1,请在图中画出从第25 min末 ~ 45min末NH3浓度的变化曲线。
参考答案:(9分)
(1)< (1分)
(2)C (1分)
(3)0.12 或 (2分)
(2分)
(4)① 或0.15 (2分)
或0.15 (2分)
②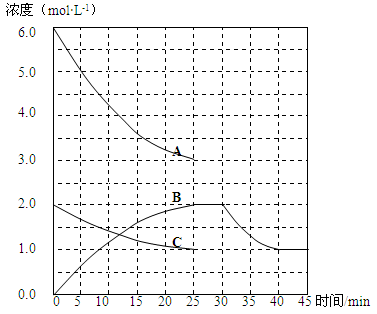 (3分,每段各1分)
(3分,每段各1分)
本题解析:(1)因为N2与H2的反应为可逆反应,所以1mol N2与3mol H2只能反应一部分,则放出的热量<92kJ。
(2)N2、H2、NH3的转化浓度之比为1:3:2,所以符合N2浓度变化的曲线为C。
(3)用H2浓度的变化表示该反应在0~25min末的速率v(H2)=(6.0mol?L?1—3.0mol?L?1)÷25min=0.12 或 mol·L-1·min-1。
mol·L-1·min-1。
(4)①平衡常数K =c2(NH3)÷[c(N2)?c3(H2)]=2.02÷(1.0×3.03)= 或0.15。
或0.15。
②25min~30min为化学平衡阶段,NH3的浓度不变;30~35min,平衡向逆反应方向移动,NH3的浓度由2.0mol?L?1减少至1.0mol?L?1,40min~45min为化学平衡状态,NH3的浓度不变,可画出变化曲线。
考点:本题考查可逆反应、图像的分析及绘画、化学反应速率和平衡常数的计算。
本题难度:一般
3、选择题 已知:H2(g)+I2(g)?2HI(g)△H=-14.9kJ/mol.某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示.甲中反应达到平衡时,测得c(H2)=0.008mol/L.?下列判断正确的( )
| 起始浓度 | c(H2)/mol/L | c(I2)/mol/L | c(HI)/mol/L
甲
0.01
0.01
0
乙
0.02
0.02
0
|