微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=
0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是(?)
A.原溶液的浓度为0.1mol/L
B.反应后溶液中c(Fe3+)=0.1mol/L
C.原溶液中c(Br?)="0.4mol/L"
D.反应后溶液中c(Fe3+)=c(Fe2+)
参考答案:B
本题解析:略
本题难度:简单
2、计算题 (9分)超氧化钾(KO2)能与水发生如下反应:4KO2+2H2O=4KOH+3O2↑。将14.2g超氧化钾投入足量水中,超氧化钾全部溶解。计算:
(1)反应生成的O2在标准状况下的体积;
(2)反应生成的K+个数;
(3)向反应后的溶液中加入足量的稀硫酸后,溶液中存在的K+个数。
参考答案:(1)3.36L(3分);(2)1.204×1023(3分);(3)1.204×1023(3分)
本题解析:(1)14.2g超氧化钾的物质的量是14.2g/71g/mol=0.2mol,设生成氧气的物质的量是xmol,根据
4KO2+2H2O=4KOH+3O2↑
3
x
则有4:3=0.2:x,解得x=0.15mol,所以反应生成的氧气在标准状况下的体积是0.15mol×22.4L/mol=3.36L
(2)根据K元素守恒,生成的K+的物质的量也是0.2mol,所以K+的个数是0.2mol×6.02×1023mol-1=1.204×1023;
(3)生成的氢氧化钾与稀硫酸反应生成硫酸钾和水,K+的个数不变,仍是1.204×1023。
考点:考查物质的量的有关计算
本题难度:困难
3、选择题 设阿伏加德罗常数为NA,则下列说法正确的是(?)
A 氧气的摩尔质量为32克
B 标准状况下,0.3molSO2中含氧原子数为0.3NA
C 常温下,2.7克Al3+所带的电荷数为0.3 NA
D 常温下,9.5克MgCl2晶体中含Mg2+为0.2 NA
参考答案:C
本题解析:考查阿伏加德罗常数的相关知识
A、摩尔质量的单位错误:g/mol,排除
B、0.3molSO2中含氧原子数为0.6NA,不正确
C、2.7克Al3+所带的电荷数为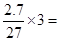 0.3 NA,正确
0.3 NA,正确
D、9.5克MgCl2晶体中含Mg2+为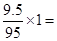 0.1NA,不正确
0.1NA,不正确
答案为C
本题难度:简单
4、选择题 0.5L 1mol/L FeCl3溶液与0.2L 1mol/L KCl溶液中的Cl-的物质的量浓度之比
A.1 : 3
B.5 : 2
C.15 : 2
D.3 : 1
参考答案:D
本题解析:根据化学式可知,1mol/L FeCl3溶液与1mol/L KCl溶液中的Cl-的物质的量浓度3.0mol/L和1mol/L,所以答案选D。
本题难度:简单
5、选择题 设NA为阿伏加德罗常数的值,下列叙述不正确的是
A.36g镁在足量的氮气中完全燃烧共转移的电子数为3NA
B.室温下,21.0g乙烯和丁烯的混合气体中含有的C-H共价键数目为3NA
C.标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA
D.1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
参考答案:C
本题解析:金属镁在反应中失去2个电子,所以36g镁共失去3mol电子,A正确。乙烯和丁烯的最简式均是CH2,所以21.0g乙烯和丁烯的混合气体中含有的C-H共价键数目为
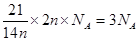 ?,B正确。NO和O2混合发生反应2NO+O2=2NO2,且生成的NO2
?,B正确。NO和O2混合发生反应2NO+O2=2NO2,且生成的NO2
?
又存在可逆反应2NO2 N2O4,所以C不正确。Na2O和Na2O2中阳离子和阴离子的个数比均是2︰1,因此D正确。答案C。
N2O4,所以C不正确。Na2O和Na2O2中阳离子和阴离子的个数比均是2︰1,因此D正确。答案C。
本题难度:一般