微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1
③H2(g)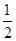 O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
④H2O(g)=H2O(l)ΔH=-44.0 kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
C.氢气的燃烧热为241.8 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=+571.6 kJ·mol-1
参考答案:A
本题解析:燃烧热是指1 mol物质燃烧生成稳定氧化物所放出的热量,C完全燃烧的产物是CO2,CO继续燃烧生成CO2放出热量,那么C的燃烧热大于110.5 kJ·mol-1;浓硫酸中的H+与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量,但是浓硫酸的稀释又有热量释放,所以该反应过程放出的热量大于57.3 kJ;根据盖斯定律,③④相加得到热化学方程式H2(g)+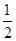 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1,该反应为放热反应,故ΔH的符号为“-”。
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1,该反应为放热反应,故ΔH的符号为“-”。
本题难度:一般
2、选择题 室温下,水的电离达到平衡:H2O H++OH-。下列叙述正确的是
H++OH-。下列叙述正确的是
A.将水加热,平衡向正向移动,Kw不变
B.向水中加入少量NaOH固体,平衡向逆向移动,c(OH-)增大
C.新制氯水久置后,水的电离平衡向正向移动,c(OH-)增大
D.向水中加入少量CH3COONa固体,平衡向正向移动,Kw增大
参考答案:B
本题解析:电离是吸热的,所以升高温度,促进水的电离,水的离子积常数也增大,A不正确。氢氧化钠电离出OH-,增大OH-浓度,抑制水的电离,B正确。新制氯水久置后,变成向盐酸,酸性增强,抑制水的电离,C不正确。醋酸钠是强碱弱酸盐,CH3COO-水解促进水的电离,但水的离子积常数不变,D不正确,答案选B。
本题难度:简单
3、选择题 下列溶液一定呈中性的是
A.PH=7的溶液
B.c(H+)=1.0×10-7mol/L的溶液
C.c(H+)= c(OH-)
D.PH=3的酸与PH=11的碱等体积混合后的溶液
参考答案:C
本题解析:溶液呈中性时,c(H+)一定等于c(OH-);
只有在常温下,中性溶液才满足ABD选项,故答案为C
本题难度:一般
4、选择题 下列说法正确的是
A.0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大
B.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的1/2
C.相同浓度的HCl和CH3COOH,两溶液中c(H+)相同
D.甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的c(H+)之比为10:1
参考答案:A
本题解析:略
本题难度:简单
5、选择题 某温度下向20mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化)。下列说法中正确的是(?)
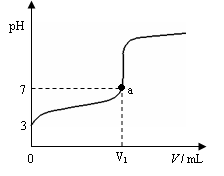
A.该温度下醋酸的电离平衡常数约为1×10-5mol·L-1
B.图中V1 > 20mL,且a点对应的溶液中:
c (Na+)+ c (H+) = c (OH-)+ c (CH3COO-)
C.图中V1 < 20mL,且a点对应的溶液中:
c (CH3COOH) + c (CH3COO-)<c (Na+)
D.当加入Na OH溶液的体积为20mL时,溶液中: