微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 除去括号内的杂质,写出所加试剂的化学式
(1)Cl-(SO42-):?(2)SO42-(CO32-):?(3)Fe2+(Cu2+):?
参考答案:(1)BaCl2?(2)H2SO4?(3)Fe
本题解析:(1)向试剂中加入BaCl2,这时发生离子反应:SO42-+Ba2+=BaSO4↓,杂质产生沉淀而除去。(2)向试剂中加入稀硫酸,发生离子反应:2H++CO32-=H2O+CO2↑.碳酸根离子生成气体除去。(3)向溶液中加入足量的还原铁粉,这时发生反应:Fe+Cu2+=?Fe2++Cu。铜离子被还原除去。
本题难度:一般
2、选择题 除去下列物质中的杂质,所用试剂和方法不正确的是
?
| 物质
| 杂质
| 除杂质所用试剂和方法
|
A
| KCl溶液
| I2
| CCl4,萃取分液
|
B
| CO2
| HCl
| 饱和NaHCO3溶液,洗气
|
C
| CaCO3
| CaO
| 盐酸,过滤
|
D
| Mg粉
| Al粉
| NaOH溶液,过滤
|
?
参考答案:C
本题解析:A选项中,碘易溶于CCl4,且CCl4与KCl不容。正确。B选项饱和NaHCO3溶液能和氯化氢反应生成二氧化碳,可除杂。正确。C选项加入盐酸后,两都都与盐酸发生反应错误。D选项铝能溶于NaOH溶液中,镁不溶解,再通过过滤进行分离即可
本题难度:一般
3、选择题 可以用分液漏斗分离的一组混合物是
A.溴和CCl4
B.苯和溴苯
C.乙醛和水
D.溴苯和水
参考答案:D
本题解析:分液漏斗分离互不相溶的液体。苯和四氯化碳都是优良的有机溶剂,溴能溶于四氯化碳,溴苯能溶于苯,乙醛与水任意比互溶,溴苯不溶于水且密度比水大。
点评:所有烃都不溶于水且密度比水小,卤代烃都不溶于水。乙醇、乙醛、乙酸能与水任意比互溶。
本题难度:一般
4、填空题 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:

已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)变化曲线如图。

(1)加MgO后过滤所得滤渣的主要成分为?。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全??。
(3)加入NaClO3饱和溶液会发生如下反应:
MgCl2+2NaClO3 Mg(ClO3)2+2NaCl↓,
Mg(ClO3)2+2NaCl↓,
请利用该反应,结合右图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应,②?;③?;④?;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O。
2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(4)上述产品测定中需要检查是否漏液的仪器有?。
步骤3中若滴定前不用标准液润洗滴定管,会导致最终结果偏?。(填“大”或“小”)。
(5)产品中Mg(ClO3)2·6H2O的质量分数为?。(计算结果保留两位小数)
参考答案:(1)BaSO4和Fe(OH)3?
(2)静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全(现象+判断1分)
(3)①蒸发结晶?②趁热过滤?③ 冷却结晶?
(4)容量瓶?滴定管?偏小
(5)78.31%
本题解析:(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,其中玻璃仪器有:漏斗、玻璃棒、烧杯,加入氧化镁,调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,钡离子已经和硫酸根离子只碱反应生成了硫酸钡沉淀,故答案为:漏斗、玻璃棒、烧杯;BaSO4和Fe(OH)3;
(2)检验硫酸根离子是否除净的方法:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42﹣沉淀完全,故答案为:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42﹣沉淀完全;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶;趁热过滤;冷却结晶;
(4)上述产品测定中需要检查是否漏液的仪器有容量瓶和滴定管 。步骤3中若滴定前不用标准液润洗滴定管,相当于把标准液稀释了,消耗的标准液的体积就会偏高,会导致最终结果偏小。
(5)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O;②根据化学方程式:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O以及Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3﹣~6Fe2+,Cr2O72﹣~6Fe2+,用0.100mol?L﹣1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol?L﹣1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10﹣3L×1.000mol?L﹣1﹣0.009mol=0.011mol,氯酸根离子的物质的量为: ×0.011mol,产品中Mg(ClO3)2?6H2O的质量分数:(
×0.011mol,产品中Mg(ClO3)2?6H2O的质量分数:( ×0.011×299g/mol)×10×
×0.011×299g/mol)×10× ×100%=78.3%.故答案为:78.3%。
×100%=78.3%.故答案为:78.3%。
本题难度:一般
5、实验题 (16分)某同学用下图装置做浓硫酸与木炭反应的实验,以及检验生成的CO2和SO2。已知:C中的酸性高锰酸钾溶液具有强氧化性,能吸收具有还原性的SO2气体。据此回答下列问题:

(1)木炭与浓H2SO4在加热条件下反应的化学方程式为:?
(2)装置B观察到的现象是?,得出的结论是?
(3)装置D观察到的现象是?,得出的结论是?
(4)装置E观察到的现象是?,得出的结论是?。
该装置中发生的离子方程式是?。
参考答案:(1)C+2H2SO4(浓)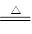 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(2)品红褪色;产物中有SO2;?(3)品红不褪色;SO2已除尽
(4)澄清石灰水变浑浊;产物中有CO2;CO2+Ca2++2OH-=CaCaO3↓+H2O
本题解析:(1)浓硫酸具有强氧化性,在加热的条件下,能把木炭氧化生成CO2、SO2和水,反应的方程式是C+2H2SO4(浓)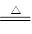 CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(2)SO2具有漂白性,能使品红溶液褪色,所以B中的实验现象是品红褪色,这就说明反应中有SO2生成。
(3)由于SO2还具有还原性,能被酸性高锰酸钾溶液氧化,所以C的作用是除去SO2,则D中的品红溶液不再褪色,这说明SO2已经被完全除尽。
(4)CO2能使澄清的石灰水变混浊,据此可以检验CO2的存在,反应的离子方程式是CO2+Ca2++2OH-=CaCaO3↓+H2O。
点评:由于SO2也能使澄清的石灰水变混浊,所以在检验CO2之前必须除去SO2。为保证SO2完全被除尽,还需要再通过品红溶液进行检验,这是设计该实验的关键。
本题难度:一般