微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)在两份体积相同的NaOH溶液中,分别通入CO2气体,充分反应后,在所得溶液A、B中分别加入1mol/L的盐酸,所加盐酸体积(mL)与产生CO2气体的体积(L)的关系如图所示,试填写下列空白:

⑴两份NaOH溶液A和B的物质的量浓度之比为?,通入CO2气体的体积之比是(相同条件)?。
⑵与盐酸反应前,A溶液中的溶质是?,其物质的量之比是?。
⑶与盐酸反应前,B溶液中的溶质是?,其物质的量之比是?。
参考答案:
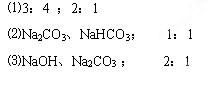
本题解析:略
本题难度:一般
2、选择题 金属钠分别与下列溶液反应时,既有气体又有沉淀产生的是
A.HCl
B.NaCl
C.FeCl3
D.Na2SO4
参考答案:C
本题解析:A、钠是活泼的金属,溶于水首先和水反应生成氢氧化钠和氢气,然后生成的氢氧化钠再和溶液中的溶质发生复分解反应,据此可以判断。A、钠投入到盐酸溶液中生成氯化钠、水和氢气,A不正确;B、钠投入到氯化钠溶液中生成氢氧化钠和氢气,B不正确;C、钠投入到氯化铁溶液中生成氢氧化铁红褐色沉淀、氯化钠和氢气,C不正确;D、钠投入到硫酸钠溶液中生成氢氧化钠和氢气,D不正确,答案选C。
本题难度:一般
3、选择题 下列物质必须隔绝空气保存的是( )
①Na ②Na2O ③Na2O2 ④NaOH ⑤NaCl
A.①②
B.②③④⑤
C.①②③④
D.①②③④⑤
参考答案:C
本题解析:钠能与空气中氧气和水反应,须密封保存;氧化钠、过氧化钠能与空气中水和二氧化碳反应,须密封保存;氢氧化钠能吸水潮解而且还能与空气中二氧化碳反应而变质,须密封保存。氯化钠与空气中水、氧气和二氧化碳均不反应,不需密封保存。
点评:保存试剂要考虑试剂可能与空气中水、氧气、二氧化碳反应。
本题难度:一般
4、填空题 (6分)(1)向饱和Na2CO3溶液中通入CO2,现象是?,原因是
①?;②??;③?。
(2)明矾在水溶液中的电离方程式为:?,实验室中若用明矾来制取Al(OH)3,则发生反应的离子方程式为:?。
参考答案:(1)有白色晶体析出 ,① NaHCO3溶解度较小?②溶剂质量减小③溶质质量增加。
(2) KAl(SO4)2=K++Al3++2SO42-?Al3++3NH3·H2O=Al (OH)3↓+3NH4+
本题解析:(1)碳酸钠与二氧化碳反应后要生成碳酸氢钠:Na2CO3+CO2+H2O═2NaHCO3↓,而碳酸氢钠的溶解度小于碳酸钠,所以溶液变浑浊(或有晶体析出)。
(2) 明矾即KAl(SO4)2是强电解质,溶于水全部电离,电离方程式为KAl(SO4)2=K++Al3++2SO42-。实验室制取Al(OH)3用的是含Al3+的化合物和氨水,离子方程式为Al3++3NH3·H2O=Al (OH)3↓+3NH4+。
点评:书写化学方程式时,首先分析应用的原理,然后根据反应物、生成物书写方程式,注意要遵守书写规则。
本题难度:一般
5、填空题 纯碱(化学式为Na2CO3)是一种重要的化工原料。现代化工生产有三种工艺:
一、布兰制碱法。以食盐为原料制碱,该法分三步:
①用氯化钠与硫酸反应制硫酸钠:2NaCl+H2SO4=Na2SO4+2HCl;
②用焦炭还原硫酸钠得硫化钠:Na2SO4+4C=Na2S+4CO↑
③用硫化钠与石灰石反应制碳酸钠:Na2S+CaCO3=Na2CO3+CaS
二、氨碱法即索尔维制碱法。以食盐、氨、二氧化碳为原料,其反应也分三步进行:
①NH3+CO2+H2O=NH4HCO3
②NH4HCO3+NaCl=NaHCO3+NH4Cl
③2NaHCO3=Na2CO3+CO2↑+H2O
三、候氏制碱法。低温下先向饱和食盐水中通入氨气,再通入二氧化碳可析出碳酸氢钠,再加入细盐末,因同离子效应,低温氯化铵溶解度突然降低,而食盐的溶解度变化不大,所以氯化铵析出而食盐不析出;再用氨饱和后通二氧化碳,结果往返析出NaHCO3和NH4Cl。该法生产的纯碱质量优良,纯白如雪。
(1)通过三种方法的比较,布兰制碱法工艺的缺点有?(写两点)。
(2)氨碱法工艺的中循环利用的物质是?(填化学式);产品的副产物NH4Cl既可以做氮肥又可以重新生成氨气。写出NH4Cl与生石灰反应的化学方程式?。
(3)候氏制碱法反应的方程式为?。
(4)为什么候氏制碱法工艺中先向饱和食盐水中通入氨气,再通入二氧化碳。理由是?(写两点)。
(5)候氏制碱法产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,用m1表示加热前纯碱样品的质量,m2表示加热后固体的质量。则纯碱中碳酸氢钠的质量分数可表示为:?。
参考答案:(1)生产时需要高温;硫酸对设备腐蚀严重;CaS废弃物长期堆积臭气四溢;成本较高。(4分,答出以上任意两点各2分,其他合理答案均给分)
(2)CO2(1分)?2NH4Cl+CaO 2NH3↑+CaCl2+H2O(2分)
2NH3↑+CaCl2+H2O(2分)
(3)NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl(2分)
(4)CO2在水中的溶解度较小,吸收率低;后通入CO2保证全部生成NaHCO3(4分,答出以上任意两点各2分,其他合理答案均给分)
(5)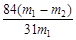 (2分)
(2分)
本题解析:(1)布兰制碱法工艺的缺点有焦炭还原硫酸钠时需要高温;硫酸对设备腐蚀严重;CaS废弃物长期堆积臭气四溢;成本较高等;
(2)从化学方程式中得出氨碱法工艺的中循环利用的物质是CO2;氯化铵与生石灰反应生成氨气、氯化钙、水,化学方程式为2NH4Cl+CaO 2NH3↑+CaCl2+H2O;
2NH3↑+CaCl2+H2O;
(3)候氏制碱法的原理是向饱和食盐水中通入氨气,再通入二氧化碳可析出碳酸氢钠,所以化学方程式为NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl ;
(4)因为二氧化碳在水中的溶解度较小,不易生成碳酸氢钠,所以先通入氨气,使溶液呈碱性,再通入二氧化碳可增大二氧化碳的吸收量从而生产碳酸氢钠;
(5)碳酸氢钠受热易分解,生成碳酸钠、水和二氧化碳,最终该固体为碳酸钠,所以质量减轻(m1-m2)g,每消耗168g碳酸氢钠,固体质量减轻62g,所以固体中碳酸氢钠的质量是168(m1-m2)/62g,所以样品中碳酸氢钠的质量分数是168(m1-m2)/62/m=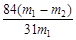 。
。
本题难度:困难