微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 LiFePO4电视具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池反应为:FePO4+Li
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,电解质为含Li+的导电固体.下列有关LiFePO4电池说法正确的是( )
A.可加入硫酸以提高电解质的导电性
B.放电时电池内部Li+向负极移动
C.充电过程中,电池正极材料的质量增加
D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
参考答案:A、金属锂可以和硫酸发生化学反应,所以不能加入硫酸以提高电解质的导电性,故A错误;
B、放电时,是原电池的工作原理,原电池中,阳离子移向正极,故B错误;
C、根据电池反应:FePO4+Li LiFePO4,充电时,正极材料LiFePO4被消耗,质量减少,故C错误;
D、放电时,是原电池的工作原理,正极反应为:FePO4+Li++e-═LiFePO4;故D正确;
故选D.
本题解析:
本题难度:简单
2、选择题 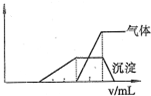 1L某混合溶液.可能含有的离子如下表:
1L某混合溶液.可能含有的离子如下表:
A.该溶液中确定含有的离子有:H+、NH4+、Al3+
B.肯定不存在的阴离子有:I-、ClO-、AlO2-
C.不能确定是否含有的阳离子有:K+
D.溶液中含有的Al3+和NH4+的物质的量之比为1:2
参考答案:B
本题解析:分析:根据产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系的图示可以知道,刚加入氢氧化钠溶液时,没有产生沉淀;之后产生了沉淀,且沉淀完全溶解;沉淀溶解前产生了气体,该气体一定是氨气;
以上分析依据,分别对离子存在情况作出判断.
解答:根据图示,开始时没有沉淀生成,说明溶液中氢离子,一定没有ClO-、AlO2-;随后出现沉淀,且沉淀完全溶解了,说明沉淀是氢氧化铝,溶液中一定含有铝离子,一定没有AlO2-,;氢氧化铝溶解前生成了气体,该气体一定是氨气,故溶液中一定含有铵离子;
A、该溶液中确定含有的离子有H+、NH4+、Al3+,故A正确;
B、一定不存在ClO-、AlO2-,不能确定I-,故B错误;
C、不能确定的有Cl-、Br-、I-、和K+,故C正确;
D、根据图示,溶解氢氧化铝消耗了氢氧化钠溶液体积是生成氨气消耗氢氧化钠溶液体积的一半,故溶液中含有的Al3+和NH4+的物质的量之比为1:2,故D正确;
故选B.
点评:本题是离子推断题,考查离子的检验方法及图示理解、分析能力,难度适中.
本题难度:简单
3、填空题 我国首创的以铝-空气-海水电池为能源的新型海水标志灯已研制成功.这种灯以取之不尽的海水为电解质溶液,靠空气中的氧气使铝不断氧化而源源产生电流.此种新型电池中铝作______极,电极上发生的是______反应(“氧化”或“还原”),电极反应式为______.
参考答案:原电池中,较活泼金属做负极,较不活泼金属或非金属做正极,
铝较活泼,易被氧化而失去电子,应做原电池的负极,
原电池工作时,负极发生反应为Al-3e-=Al3+,
故答案为:负;氧化,Al-3e-=Al3+.
本题解析:
本题难度:一般
4、选择题 可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解质溶液时,正极反应都为: O2+2H2O+4e-===4OH-
B.以NaOH溶液为电解质溶液时,负极反应为:(提示:氢氧化铝溶于强碱)Al+3OH--3e-===Al(OH)3↓
C.以NaOH溶液为电解质溶液时,电池在工作过程中电解质溶液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
参考答案:A
本题解析:原电池中正极得到电子,发生还原反应,A正确。溶液显强碱性,氢氧化铝不可能存在,电极反应式为Al+4OH--3e-===AlO2-+2H2O,B不正确。根据电极反应式可知反应是消耗氢氧化钠的,溶液的pH减小,C不正确。原电池负极失去电子,电子经导线传递到正极上,D不正确。答案选A。
本题难度:简单
5、选择题 已知镍氢电池的某极是储氢合金X(合金X结合氢气的形式可表示为XH6),另一电极为NiOOH/Ni(OH)2,其总反应式为:
XH6+6NiOOH
X+6Ni(OH)2.下列说法正确的是( )
A.充电时电源的正极与电池的X极相连
B.放电时负极电极反应式为:XH6+6e-═X+6H+
C.充电时阳极电极反应式为:6Ni(OH)2+6OH--6e-═6NiOOH+6H2O
D.电池放电时反应了1?mol?XH6,若用于电解水,理论上可得到16?g氧气
参考答案:A、总反应式为:XH6+6NiOOH放电
本题解析:
本题难度:简单