| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《常见的化学电源》考点特训(2017年冲刺版)(四)
参考答案:A 本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以甲醇在负极通入,氧气在正极通入,即a是负极,b是正极。电极反应式分别为CH3OH+H2O-6e- = CO2+6H+、O2+4H++4e-=2H2O,所以只有选项A是正确的,答案选A。 本题难度:一般 3、选择题 已知铅蓄电池的总反应PbO2 +Pb +2H2SO4== 2PbSO4 + 2H2O ,图为铁铆钉铆在铜板上,有关叙述不正确的是 参考答案:A 本题解析: 本题难度:一般 4、选择题 如图是一种可充电的锂离子电池充、放电的工作示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++x e-=LiMnO2(LiMnO2表示含锂原子的MnO2)下列有关说法正确的是 |
参考答案:B
本题解析:由题意放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++x e-=LiMnO2(LiMnO2表示含锂原子的MnO2),故A项电池反应充、放电反了,故A项错误;K与M相接时,B电极接电源负极作阴极,A电极接电源正极做阳极,故B项正确;则该电池做电源时,A为正极,B为负极,K与N相接时,Li+由B极区迁移到A极区,故C项错误;由图象可知充电过程中为电能转化为化学能,放电过程中为化学能转化为电能和光能,故D项错误;本题选B。
考点:电化学原理。
本题难度:困难
5、填空题 (14分)用CO2生产绿色燃料甲醇时发生反应A:CO2(g)+ 3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(1)2CH3OH(g) + 3O2 (g) ="==" 2CO2(g) + 4H2O(g) △H= -1365.0KJ/mol
H2(g) +1/2 O2 (g) ="==" H2O(g) △H=" -241.8" KJ/mol
CO2(g)+ 3H2(g) CH3OH(g) + H2O(g)的反应热△H= 。
CH3OH(g) + H2O(g)的反应热△H= 。
(2)在体积为1 L的恒容密闭容器中发生反应A,下图是在三种投料[n(CO2)和n(H2)分别为1mol,3mol;1mol,4mol和1mol,6mol]下,反应温度对CO2平衡转化率影响的曲线。
①曲线c对应的投料是 。
②T1℃时,曲线a对应的化学平衡常数是 。
③500℃时 ,反应A的平衡常数K=2.5,T1℃ 500℃(填“高于” 、“低于” 或“等于” )。
(3)甲醇/过氧化氢燃料电池的工作原理示意图如下: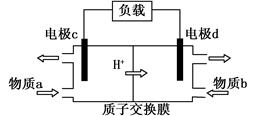
①d电极上发生的是 (填“氧化”或“还原”)反应。
②物质b是 (填化学式)。
③写出c电极的电极反应式 。
参考答案:(1)△H = -42.9kJ/mol(2分)
(2)① n(CO2)=1mol,n(H2)="6mol" (2分) ②0.52(2分) ③高于(2分)
(3)①还原(2分) ②H2O2 (2分)③CH3OH — 6e— + H2O===CO2 + 6H+ (2分)
本题解析:(1)已知:①2CH3OH(g) + 3O2 (g) ="==" 2CO2(g) + 4H2O(g) △H=" -1365.0KJ/mol" ②H2(g) +1/2 O2 (g)===H2O(g)△H="-241.8" KJ/mol,根据盖斯定律:②×3—①×1/2得CO2(g)+3H2(g) CH3OH(g) + H2O(g)的反应热△H=-42.9kJ/mol。(2)①当其他条件不变时,增大反应物氢气的浓度,平衡正向移动,CO2的平衡转化率增大,由题给图像知相同温度下,曲线c二氧化碳的平衡转化率最大,故曲线c对应的投料是n(CO2)=1mol,n(H2)=6mol。②曲线a对应的投料是n(CO2)=1mol,n(H2)=3mol,T1℃时,二氧化碳的平衡转化率为60%,由CO2(g)+3H2(g)
CH3OH(g) + H2O(g)的反应热△H=-42.9kJ/mol。(2)①当其他条件不变时,增大反应物氢气的浓度,平衡正向移动,CO2的平衡转化率增大,由题给图像知相同温度下,曲线c二氧化碳的平衡转化率最大,故曲线c对应的投料是n(CO2)=1mol,n(H2)=6mol。②曲线a对应的投料是n(CO2)=1mol,n(H2)=3mol,T1℃时,二氧化碳的平衡转化率为60%,由CO2(g)+3H2(g) CH3OH(g) + H2O(g)知,各物质的平衡浓度分别为:c(CO2)=0.4mol/L,c(H2)="1.2mol/L" ,c(CH3OH)=0.6mol/L,c(H2O)=0.6mol/L,代入平衡常数表达式计算,曲线a对应的化学平衡常数是0.52。③由(1)知反应为放热反应,升高温度平衡逆向移动,平衡常数减小,若500℃时 ,反应A的平衡常数K=2.5,T1℃高于500℃。(3)①由甲醇/过氧化氢燃料电池的工作原理示意图知,氢离子移向d电极,d电极为电池的正极,发生的是还原反应;②物质b在d电极上发生还原反应,物质b是H2O2。③c电极为电池的负极,甲醇在该电极上反应氧化反应生成二氧化碳,电极反应式为CH3OH — 6e— + H2O===CO2 + 6H+。
CH3OH(g) + H2O(g)知,各物质的平衡浓度分别为:c(CO2)=0.4mol/L,c(H2)="1.2mol/L" ,c(CH3OH)=0.6mol/L,c(H2O)=0.6mol/L,代入平衡常数表达式计算,曲线a对应的化学平衡常数是0.52。③由(1)知反应为放热反应,升高温度平衡逆向移动,平衡常数减小,若500℃时 ,反应A的平衡常数K=2.5,T1℃高于500℃。(3)①由甲醇/过氧化氢燃料电池的工作原理示意图知,氢离子移向d电极,d电极为电池的正极,发生的是还原反应;②物质b在d电极上发生还原反应,物质b是H2O2。③c电极为电池的负极,甲醇在该电极上反应氧化反应生成二氧化碳,电极反应式为CH3OH — 6e— + H2O===CO2 + 6H+。
考点:考查反应热的计算、盖斯定律,化学平衡和燃料电池。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《物质的组成.. | |