微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。请用离子方程式说明上述除杂的原理____________。
(2)工业上为了处理含有Cr2O72-的酸性工业废水, 用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原 成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为_________________________________。
②常温下,Cr(OH)3的溶度积Ksp =1×10—32,溶液的pH至少为 ,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg?L—1的废水,需用绿矾的质量为 kg。(写出计算过程,保留到小数点后一位)
参考答案:(1) FeS+ Cu2+= CuS+Fe2+ (2)①Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O ②5 ③125.1kg
本题解析:(1)由于Ksp(FeS)>Ksp(CuS),所以在相同条件下CuS的溶解度更小,沉淀会向着生成CuS的方向进行,离子方程式为FeS+ Cu2+= CuS+Fe2+;
(2)①工业上为了处理含有Cr2O72-的酸性工业废水,用绿矾(FeSO4 ?7H2O)把废水中的六价铬离子还原成三价铬离子,Cr2O72-的酸性工业废水中加入硫酸亚铁反应生成铁离子,三价铬离子和水,反应的离子方程式为Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②常温下,Cr3+沉淀完全浓度小于10-5mol/L,Cr(OH)3的溶度积Ksp=1×10-32=c(Cr3+)c3(OH-),c3(OH-)=(1×10-32)/ 10-5 =10-27,c(OH-)=1×10-9mol/L,依据离子积Kw=c(H+)c(OH-),c(H+)=10-5(mol/L),溶液pH=5;
③ Cr3+ ~ 3 FeSO4·7H2O
1 3
78g?m—3×100 m3/52g?mol—1 n( FeSO4·7H2O)
解得n(FeSO4·7H2O)=450mol m(FeSO4·7H2O)= 450mol×278g?mol—1=125.1kg
考点:考查沉淀溶解平衡的应用,废水的综合治理,PH值的计算等知识。
本题难度:困难
2、选择题 在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)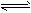 Ca(OH)2(aq)
Ca(OH)2(aq)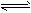 Ca2+(aq)
Ca2+(aq)
+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是
[? ]
A.n(Ca2+)增大
B.c(Ca2+)不变
C.n(OH-)增大
D.c(OH-)减小
参考答案:B
本题解析:
本题难度:一般
3、填空题 (12分)纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛。以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
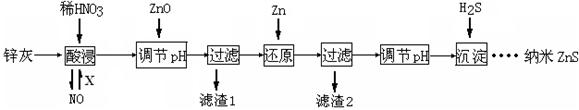
请回答下列问题。
(1)酸浸时FeO与稀HNO3反应的离子方程式 。
(2)将酸浸的尾气循环利用,加入的X气体可以是 。
(3)流程中加入ZnO调pH的目的是 。
(4)滤渣2中的成分是 。
(5)已知ZnS的溶度积Ksp=1.6×10-24,溶液中Zn2+浓度为0.01mol·L-1,则溶液中S2—浓度大于 mol·L一1,才生成ZnS沉淀。
(6)试设计简单实验方案,判断所得ZnS样品颗粒是否为纳米级 。
参考答案:(1)3FeO+10H++NO3—=3Fe3++NO+5H2O (2分)
(2)空气(或O2) (2分)
(3)除去溶液中的Fe3+ (2分)
(4)Cu、Zn (2分)
(5)1.6×10—22 (2分)
(6)取少量样品和水混合形成分散系,让一束光照射,若出现一条光亮的通路,则是纳米级,否则不是。 (2分)
本题解析:(1)HNO3把FeO氧化为Fe3+,HNO3被还原为NO,配平可得离子方程式:3FeO+10H++NO3—=3Fe3++NO+5H2O
(2)NO与O2、H2O反应可生成HNO3,实现尾气循环利用,所以X气体为空气(或O2)。
(3)加入硝酸后,与Fe2O3、FeO反应生成Fe3+,流程中加入ZnO调pH可使Fe3+转化为Fe(OH)3沉淀,所以加入ZnO调pH的目的是除去溶液中的Fe3+
(4)加入Zn后,Zn与Cu2+反应生成Cu,所以滤渣2中的成分是Cu、Zn
(5)c(S2?)= Ksp÷c(Zn2+)=1.6×10-24÷0.01=1.6×10—22mol?L?1,所以溶液中S2—浓度大于1.6×10—22mol?L?1,才生成ZnS沉淀。
(6)纳米级颗粒与水混合可形成胶体,具有丁达尔效应,所以实验方案为:取少量样品和水混合形成分散系,让一束光照射,若出现一条光亮的通路,则是纳米级,否则不是。
考点:本题考查化学流程的分析、离子方程式的书写、除杂、胶体的性质、Ksp的计算。
本题难度:一般
4、选择题 水中加入下列溶液对水的电离平衡不产生影响的是
A.NaHSO4溶液
B.NaOH溶液
C.KAl(SO4)2溶液
D.KI溶液
参考答案:D
本题解析:水是弱电解质,存在电离平衡H2O H++OH-。所以酸或碱都能抑制水的电离,而能发生水解的盐,则是促进水的电离,即A和B抑制水的电离,C促进水的电离,碘化钾比强酸强碱盐,不能水解,不会影响水的电离平衡,答案选D。
H++OH-。所以酸或碱都能抑制水的电离,而能发生水解的盐,则是促进水的电离,即A和B抑制水的电离,C促进水的电离,碘化钾比强酸强碱盐,不能水解,不会影响水的电离平衡,答案选D。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题的关键是理解并掌握外界条件对水电离平衡影响,然后结合题干灵活运用即可。
本题难度:简单
5、选择题 已知298 K时下列物质的溶度积(单位略)。
?
| CH3COOAg
| AgCl
| Ag2CrO4
| Ag2S
|
Ksp
| 2.3×10-3
| 1.77×10-10
| 1.12×10-12
| 6.7×10-15
|
?
下列说法正确的是
A.等体积、浓度均为0.02 mol·L-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.向含有浓度均为0.01 mol·L-1的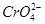 和Cl-的溶液中慢慢滴入AgNO3溶液时,
和Cl-的溶液中慢慢滴入AgNO3溶液时,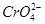 先沉淀
先沉淀
C.在CH3COOAg悬浊液中加入盐酸时发生反应的离子方程式为CH3COOAg+H++Cl-=CH3COOH+AgCl
D.298 K时,上述四种饱和溶液的物质的量浓度:
c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
参考答案:C
本题解析:Ksp(CH3COOAg)>Ksp(AgCl),向CH3COOAg悬浊液中加入盐酸时CH3COOAg转化为AgCl,离子方程式为CH3COOAg+H++Cl-=CH3COOH+AgCl,C正确。
本题难度:一般