| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《难溶电解质的溶解平衡》高频考点强化练习(2017年最新版)(十)
 参考答案:A.CaSO4饱和溶液c(Ca2+)=c(SO42-)=3×10-3mol/L,加入400mL 0.01mol/LNa2SO4溶液后,c(Ca2+)=0.6×10-3mol/L,c(SO42-)=8.6×10-3mol/L,Qc<Ksp,没有沉淀生成,故A错误; 本题解析: 本题难度:一般 2、选择题 向AgCl饱和溶液中加水,下列叙述正确的是 |
参考答案:B
本题解析:
试题解析:A、加入水多,溶解的氯化银质量多,AgCl的溶解度是指一定温度下,100g水中溶解AgCl的最大质量,与加入水的多少无关,故A错误;B、AgCl的溶解度、Ksp只受温度影响,温度不变,AgCl的溶解度、Ksp不变,故B正确;C、AgCl的Ksp只受温度影响,温度不变,AgCl的Ksp不变,故C错误;D、AgCl的溶解度、Ksp只受温度影响,温度不变,AgCl的溶解度、Ksp不变,故D错误。
考点:难溶电解质的溶解平衡及沉淀转化的本质
本题难度:一般
3、选择题 已知:25℃时,CaCO3的Ksp为2.9×10-9,CaF2的Ksp为2.7×10-11下列说法正确的是
A.25℃时,饱和CaCO3溶液与饱和CaF2溶液相比,后者Ca2+浓度大
B.25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,会析出CaCO3固体
C.25℃时,CaCO3固体在20mL0.01mol·L-1盐酸中的Ksp比在20mL0.01mol·L-1氨水中的Ksp大
D.25℃时,在CaCO3悬浊液中加入NaF固体,CaCO3不可能全转化为CaF2
参考答案:AB
本题解析:A.25℃时,CaCO3的Ksp为2.9×10-9,则c2(Ca2+)=2.9×10-9,CaF2的Ksp为2.7×10-11,则c3(Ca2+)=6.75×10-12,所以Ca2+浓度后者大,正确;B.25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,由于c (Ca2+)较大,c (Ca2+)·c(CO32-)>Ksp(CaCO3)所以会析出CaCO3固体,正确;C.物质的溶度积常数只与温度有关,而与其它条件无关,所以25℃时,CaCO3固体在20mL0.01mol·L-1盐酸中的Ksp比在20mL0.01mol·L-1氨水中的Ksp相同,错误;D.25℃时,在CaCO3悬浊液中加入NaF固体,若c (Ca2+)·c2(F-)>Ksp(CaF2),则CaCO3可能全转化为CaF2,错误。
考点:考查溶度积常数在离子浓度大小比较、沉淀的转化等的应用的知识。
本题难度:一般
4、填空题 减少SO2的排放、回收利用SO2成为世界性的研究课题.我国研究人员研制的,利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子.(提示:①在工业上,用沉淀法不能完全除去的离子还可以用 吸附法除去②有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表③阳离子?吸附剂吸附金属离子的效果见图.④已知PbO2的氧化性大于MnO2.)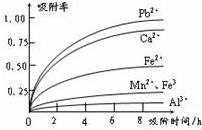
| 离子 | 离子半径(pm) | 开始沉淀pH | 完全沉淀pH Fe2+ 74 7.6 9.7 Fe3+ 64 2.7 3.7 Al3+ 50 3.8 4.7 Mn2+ 80 8.3 9.8 Pb2+ 121 8.0 8.8 Ca2+ 99 - - |
参考答案:(1)低品位软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应,反应的化学方程式为SO2+MnO2=MnSO4;
杂质离子中只有Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
故答案为:SO2+MnO2=MnSO4;2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(2)杂质中含有Fe2+、Al3+、Ca2+、Pb2+四种阳离子,由沉淀的pH范围知,Fe2+的沉淀与Mn2+离子的沉淀所需的pH接近,而Fe3+则相差很远,故可以将Fe2+氧化成Fe3+而除杂.从吸附率的图可以看出,Ca2+、Pb2+的吸附率较高,故只要调节pH值在4.7~8.3间,大于4.7可以将Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀.
故答案为:4.7~8.3.
(3)图中离子从上至下,半径有减小趋势,对应的吸附率减小.随着时间的递增,所有离子的吸附率均增大;另Fe3+和
Al3+离子所带电荷数大,其吸附率低.
故答案为:bcd.
(4)从溶液中获得溶质,应采用蒸发浓缩、冷却结晶的方法.
故答案为:蒸发浓缩、冷却结晶.
本题解析:
本题难度:一般
5、选择题 下列说法错误的是
[? ]
A.铅蓄电池在放电过程中,负极质量最终减小,正极质量最终增加
B.放热反应不一定能自发进行
C.一定条件下,使用催化剂能加快反应速率,但不能提高反应物的平衡转化率
D.温度一定,当溶液中Ag+和Cl-浓渡的乘积等于Ksp时,溶液为AgCl的饱和溶液
参考答案:A
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《键参数——.. | |