微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+3C+S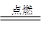 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除S外,上述元素的电负性从大到小依次为?;
②在生成物中,含极性共价键的分子的中心原子轨道杂化类型为_______, A的晶体类型为____________。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为__________,Q2+的未成对电子数是____________。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR—H―→Rx[CrCln(H2O)6-n]+xH+
交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R—H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,可知该配离子的化学式为?。
参考答案:答案:(1)①O>N>C>K ②sp杂化?离子晶体 ③1∶1 (2)3d84s2 ? 4 ? (3)[CrCl(H2O)5]2+
本题解析:(1)①钾为活泼金属,电负性较小;C、N、O在同周期,非金属性逐渐增强,电负性也逐渐增大;②K2S是离子化合物,属于离子晶体,产物中含极性共价键的分子为CO2,其空间构型为直线形,中心原子轨道杂化类型为sp杂化;③HCN中CN-与N2结构相同,含有共价三键,一个σ键和两个π键;另外和H之间形成一个σ键,所以HCN分子中σ键与π键数目之比为2∶2,即为1∶1。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,应该都属于第Ⅷ族元素,原子序数T比Q多2,可以确定T为Ni,Q为Fe,所以T的基态原子外围电子(价电子)排布为3d84s2,Q2+即Fe2+的未成对电子数是4。
(3)中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则可以得出H+的物质的量为0.1200×25.00×10-3=0.0030 (mol),所以x=0.0030/0.0015=2;Cr的化合价为+3价,x=2可以得n=1,即该配离子的化学式为[CrCl(H2O)5]2+。
点评:该题是高考中的常见考点和题型,试题综合性强,贴近高考。试题在注重基础知识的同时,侧重考查学生能力的培养和解题方法的训练与指导。有利于培养学生的逻辑推理能力和抽象思维能力,提高学生分析问题、发现问题和解决问题的能力,有利于提高学生的应试能力,提高学生的学习效率和学习积极性。
本题难度:一般
2、选择题 下列物质中,既有离子键又有共价键的离子晶体是( ? )
A.漂白粉的有效成分
B.镁铝合金
C.石英
D.足球烯
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列各分子中,所有原子都满足最外层为8个电子结构的是
[? ]
A. H2O
B. BF3
C. CCl4
D. PCl5
参考答案:C
本题解析:
本题难度:简单
4、填空题 (8分)W、X、Y、Z为原子序数依次增大的四种短周期主族元素。其中,W的一种原子核内没有中子,Y的原子最外层电子数是其内层电子数的3倍。Y与Z能形成两种常见的离子化合物Z2Y和Z2Y2。X与Y能形成两种化合物,其相对分子质量之比为7 : 11。请回答:
(1)Z在元素周期表中的位置是____。
(2)X、Z两元素原子的次外层电子数之比为____。
(3)由W与X两种元素组成的物质甲,其相对分子质量为28。甲可能发生的反应有____(填序号)。
①与氢气反应?②与氧气反应?③与水反应?④与酸性高锰酸钾溶液反应?
(4)由W、X、Y三种元素组成的有机物乙,相对分子质量为60。由W、X、Y、Z四种元素组成的无机物丙,相对分子质量为84,受热易分解。又知,乙与丙反应能放出气体,写出乙溶液与丙溶液反应的化学方程式:____。
参考答案:(8分)(1)第三周期?第ⅠA族? ……………2分
(2)1 : 4? …………2分
(3)①②③④ …………2分
(4)CH3COOH + NaHCO3 ="=" CH3COONa + CO2↑+ H2O …………2分
本题解析:
解:W、X、Y、Z为原子序数依次增大的四种短周期主族元素,W的一种原子核内没有中子,则W应为H元素,
Y的原子最外层电子数是其内层电子数的3倍,核外各电子层电子数分别为2、6,应为O元素,
Y与Z能形成两种常见的离子化合物Z2Y和Z2Y2,则Z为Na元素,形成的化合物分别为Na2O和Na2O2,
X与Y能形成两种化合物,其相对分子质量之比为7:11,相对分子质量分别为28、44,应为CO和CO2,X为C元素,
(1)Z为Na元素,原子序数为11,原子核外有3个电子层,最外层电子数为1,则应在周期表第三周期ⅠA族,故答案为:第三周期ⅠA族;
(2)X、Z分别为C、Na,核外次外层电子数分别为2、8,则两元素原子的次外层电子数之比为2:8=1:4,故答案为:1:4;
(3)W2Y为H2O,属于共价化合物,用电子式表示的形成过程为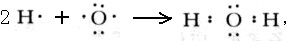
故答案为: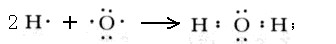
(4)由W与X两种元素组成的中学化学常见化合物甲,其相对分子质量为78,应为苯,性质稳定,不能与酸性高锰酸钾溶液反应,在催化剂条件下易发生取代反应,易燃烧,能加成,故答案为:④;
(5)由W、X、Y三种元素组成的有机物乙,相对分子质量为60,应为CH3COOH,为弱酸,由W、X、Y、Z四种元素组成的无机物丙,相对分子质量为84,受热易分解,则丙为NaHCO3,
二者反应的离子方程式为CH3COOH+HCO3-═CH3COO-+CO2↑+H2O,
故答案为:CH3COOH+HCO3-═CH3COO-+CO2↑+H2O.
本题难度:一般
5、选择题 下列分子中,没有非极性键的化合物的是(?)
A.H2
B.CO2
C.H2O2
D.C2H4
参考答案:B
本题解析:略
本题难度:简单