微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)
Ⅰ、实验室常用以下方法制取氯气:MnO2+ 4HCl(浓) 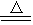 ?MnCl2+Cl2↑ + 2H2O,
?MnCl2+Cl2↑ + 2H2O,
(1)用双线桥标出电子转移方向和数目。(在答题纸上标)
(2)在标准状况下生成的Cl2为11.2L时,参加反应的HCl的物质的量为?,
被氧化HCl的质量为?。
Ⅱ、科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒。这是因为
对人体无害的+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化
合物。通过以上信息填空:
(1)维生素C具有??(填氧化性或还原性)。
(2)上述过程中+5价砷类物质作为?(填氧化剂或还原剂),+5价砷元素发生
?反应(填氧化或还原);2mol +5价砷完全转化为 +3价砷,共转移?个
电子(用NA表示阿伏加德罗常数)。
参考答案:(每空2分,共14分)
Ⅰ、(1)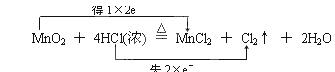 (2)2mol,36.5g。
(2)2mol,36.5g。
Ⅱ、(1) 还原性?(2)氧化剂 ;?还原?;4NA
本题解析:Ⅰ、(1)根据反应的方程式可知,盐酸中氯元素的化合价从-1价升高到0价,失去1个电子。而二氧化锰中Mn元素的化合价从+4价降低到+2价,得到2个电子,所以根据电子到得失守恒可知,正确的表示应该是 。
。
(2)氯气的物质的量是11.2L÷22.4L/mol=0.5mol,则根据反应的化学方程式可知,参加反应的氯化氢是0.5mol×4=2mol。其中被氧化的氯化氢是1mol,质量是36.5g。
Ⅱ、(1)+5价砷类化合物在维生素C的作用下,能够转化为有毒的+3价的含砷化,这说明砷元素得到电子,所以维生素C失去电子,具有还原性。
(2)As元素的化合价从+5价降低到+3价,得到2个电子,做氧化剂,则+5价砷元素发生还原反应。2mol +5价砷完全转化为 +3价砷,得到4mol电子,则共转移4NA个电子。
点评:该题是基础性试题的考查,也是高考中的常见考点,难度不大。试题放热关键是熟练掌握氧化还原反应的有关概念,判断的依据,然后再结合题意灵活分析即可。该题有利于培养学生分析问题、解决问题的能力。
本题难度:一般
2、选择题 现有下列反应式,据两式判断,下列各组离子中,还原性由强到弱的排列顺序正确的是(?)
(1)2Fe3++2I—?2Fe2++I2?(2)Br2+2Fe2+?2Fe3++2Br—
A.Br—>Fe2+>I—
B.I—>Fe2+>Br—
C.Br—>I—>Fe2+
D.Fe2+>I—>Br—
参考答案:B
本题解析:根据还原剂的还原性强于还原产物的还原性及方程式(1)2Fe3++2I-?2Fe2++I2(2)Br2+2Fe2+?2Fe3++2Br-,可知还原性:I->Fe2+>Br-。答案选B。
点评:氧化性:氧化剂大于氧化产物;还原性:还原剂大于还原产物。
本题难度:一般
3、选择题 下列反应既属于化合反应,又属于氧化还原反应的是
[? ]
A.Fe+2HCl=H2+FeCl2
B.2FeCl2+Cl2=2FeCl3
C.CaO+H2O=Ca(OH)2
D.2Fe(OH)3 =Fe2O3 +3H2O
参考答案:B
本题解析:
试题分析:
由两种或两种以上的物质反应生成一种物质的反应称为化合反应,凡是有元素化合价变化的反应称为氧化还原反应。
选项A.不属于化合反应,故A错;
选项B.既是化合反应又是氧化还原反应,故B正确;
选项C.没有元素化合价变化,不属于氧化还原反应,故C错;
选项D.没有元素化合价变化,不属于氧化还原反应,故D错;
故选:B
本题难度:简单
4、填空题 L、M、Q、R、X代表五种物质,它们都含某种价态的氮元素,各物质中氮元素的化合价只有一种。物质L中氮元素的化合价比物质M中氮元素的化合价低。在一定条件下,它们会有如下的转化关系(未配平)。
Q + HCl M+Cl2+H2O? R+L
M+Cl2+H2O? R+L X+H2O? R+O2
X+H2O? R+O2 L+ H2O
L+ H2O
请判断:
(1) 五种物质按氮元素的化合价从高到低的顺序排列是? ,
若五种物质中有一种是硝酸,那么硝酸应该是?(用字母表示)
(2) 某同学写出下面不同价态的氮的化合物相互转化关系(未配平),其中你认为一定不能实现的是(? )
A.NO+HNO3 ?N2O3+H2O? B.NH3+NO
?N2O3+H2O? B.NH3+NO HNO2+H2O?
HNO2+H2O?
C.N2O4+H2O HNO3 +HNO2
HNO3 +HNO2
参考答案:(2分×3)(1)Q、M、L、X、R? Q?(2)B
本题解析:略
本题难度:一般
5、选择题 某溶液中有Fe2+、Cl-和I-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是(?)
A.Cl2
B.KMnO4
C.FeCl3
D.HCl
参考答案:C
本题解析:分析各选项知,D中HCl无氧化性;A中的Cl2和B中KMnO4能氧化Fe2+和I-。
本题难度:一般