微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中离子浓度大小关系错误的是
A.0.1 mol/L的NH4Cl溶液中:
B.0.1mol/L的CH3COONa溶液中: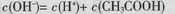
C.0.1 mol/LNa2S的溶液中:
D.pH=2的盐酸与pH=12的氨水等体积混合后: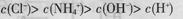
参考答案:D
本题解析:A、氯化铵溶液中铵根离子水解溶液呈酸性,溶液中离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),正确;B、为醋酸钠溶液的质子守恒式,正确;C、任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)=2[c(S2-)+c(HS-)+c(H2S)],故C正确;D、pH=12的氨水与pH=2的盐酸溶液中,氨水浓度大于盐酸,二者等体积混合,氨水过量,溶液呈碱性,所以c(H+)<c(OH-),结合电荷守恒知c(Cl-)<c(NH4+),D错误。
本题难度:一般
2、实验题 (1)(2分)甲同学在用FeSO4固体配制FeSO4溶液时,除了加入蒸馏水外,还需加?和?试剂(填化学式)
(2)(2分)乙同学为标定某醋酸溶液的准确浓度,用0.2000 mol·L—1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号
| 1
| 2
| 3
| 4
|
消耗NaOH溶液的体积(mL)
| 20.05
| 20.00
| 18.80
| 19.95
|
则该醋酸溶液的准确浓度为?。(保留小数点后四位)
(3)丙同学利用:5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O反应,用KMnO4溶液滴定某样品进行铁元素含量的测定。
①(2分)设计的下列滴定方式,最合理的是_____。(夹持部分略去)(填字母序号)

②(2分)判断滴定终点的依据是?。
参考答案:8分
(1)(2分)Fe?稀硫酸?(2)(2分)0.2000mol/L
(3)b(2分)
滴入最后一滴KMnO4溶液,溶液恰好由无色变浅紫红色,且半分钟内不褪色(2分)
本题解析:(1)FeSO4溶液易被氧化、易水解,故还需要加Fe和稀硫酸。
(2)实验序号3误差较大,舍去,用1、2、4的数据进行计算,c(CH3COOH)×0.02=[(20.05+20.00+19.95)÷3] ×0.2,解得c(CH3COOH)= 0.2000(mol/L)。
(3)①KMnO4溶液成放在酸性的滴定管中,故b正确。
②KMnO4溶液呈紫色,故判断滴定终点的依据是滴入最后一滴KMnO4溶液,溶液恰好由无色变浅紫红色,且半分钟内不褪色。
点评:本题考查盐类的水解、中和滴定的知识,题目难度不大,本题注意根据硫酸亚铁和氢氧化亚铁的性质进行判断,注意把握实验的操作原理。
本题难度:一般
3、选择题 常温下有0.1mol·L-1的NaHA溶液,其pH=9,下列说法正确的是(?)
A.c(Na+)=c(HA-)+c(A2-)+c(H2A)?
B.c(HA-)>c(Na+)>c(OH-)>c(H+)
C.c(Na+)>c(HA-)>c(OH-)>c(H2A)?
D.c(H+)+2c(H2A)= c(OH-) +c(A2-)
参考答案:AC
本题解析:由于NaHA=Na++HA-,H2O H++OH—,HA-+H2O
H++OH—,HA-+H2O H2A+OH—,HA-
H2A+OH—,HA- H++A2—,则平衡时溶液中的HA-、H2A、A2—均来自原料中的NaHA,根据物料守恒原理可得:c(Na+)=c(HA-)+c(A2-)+c(H2A),故A选项正确;由于溶液的pH=9,说明该盐是强碱弱酸盐,Na+不能水解,HA-既能微弱地水解,也能微弱的电离,且水解程度大于其电离程度,因此平衡时溶液中c(Na+)>c(HA-)>c(OH-)>c(H+),故B选项错误;由于盐电离出的HA-具有两性,则水电离出的氢离子部分与HA-反应生成H2A,即H++ HA-=H2A,该反应中H2A与H+的系数之比等于浓度之比,则被消耗的氢离子浓度等于生成的H2A的浓度,即c(H+)水= c(H+)+c(H2A),而水电离出的部分氢氧根离子与HA-中和生成水和A2—,即OH—+HA-= A2—+H2O,该反应中A2—与OH—的系数之比等于浓度之比,则被消耗的氢氧根离子浓度等于生成的A2—的浓度,即c(OH-)水= c(OH-)+c(A2—),由于水电离出的氢离子等于水电离出的氢氧根离子,则平衡时溶液中c(H+)+c(H2A)=c(OH-)+c(A2—),故D选项错误;由于溶液的pH=9,则c(H+)=10—9mol/L,由于常温下水的离子积为1.0×10—14,c(OH-)=Kw/ c(H+)=10—5mol/L,则c(H+)< c(OH-),由于HA-的水解程度大于其电离程度,则其水解产物浓度大于电离产物浓度,则c(H2A)> c(A2—),由于质子守恒关系式为c(H+)+c(H2A)=c(OH-)+c(A2—),则c(H2A)<c(OH-),由于钠离子不能水解,HA-既能微弱地水解,也能微弱的电离,则c(Na+)>c(HA-)>c(OH-)>c(H2A),故C选项正确。
H++A2—,则平衡时溶液中的HA-、H2A、A2—均来自原料中的NaHA,根据物料守恒原理可得:c(Na+)=c(HA-)+c(A2-)+c(H2A),故A选项正确;由于溶液的pH=9,说明该盐是强碱弱酸盐,Na+不能水解,HA-既能微弱地水解,也能微弱的电离,且水解程度大于其电离程度,因此平衡时溶液中c(Na+)>c(HA-)>c(OH-)>c(H+),故B选项错误;由于盐电离出的HA-具有两性,则水电离出的氢离子部分与HA-反应生成H2A,即H++ HA-=H2A,该反应中H2A与H+的系数之比等于浓度之比,则被消耗的氢离子浓度等于生成的H2A的浓度,即c(H+)水= c(H+)+c(H2A),而水电离出的部分氢氧根离子与HA-中和生成水和A2—,即OH—+HA-= A2—+H2O,该反应中A2—与OH—的系数之比等于浓度之比,则被消耗的氢氧根离子浓度等于生成的A2—的浓度,即c(OH-)水= c(OH-)+c(A2—),由于水电离出的氢离子等于水电离出的氢氧根离子,则平衡时溶液中c(H+)+c(H2A)=c(OH-)+c(A2—),故D选项错误;由于溶液的pH=9,则c(H+)=10—9mol/L,由于常温下水的离子积为1.0×10—14,c(OH-)=Kw/ c(H+)=10—5mol/L,则c(H+)< c(OH-),由于HA-的水解程度大于其电离程度,则其水解产物浓度大于电离产物浓度,则c(H2A)> c(A2—),由于质子守恒关系式为c(H+)+c(H2A)=c(OH-)+c(A2—),则c(H2A)<c(OH-),由于钠离子不能水解,HA-既能微弱地水解,也能微弱的电离,则c(Na+)>c(HA-)>c(OH-)>c(H2A),故C选项正确。
本题难度:一般
4、选择题 已知ROH为强碱,HM为弱酸,使其完全反应后的RM溶液中,各种离子浓度由小到大的顺序是()
A.c(OH-)<c(H+)<c(M-)<c(R+)
B.c(H+)<c(M-)<c(R+)<c(OH-)
C.c(H+)<c(OH-)<c(M-)<c(R+)
D.c(R+)<c(M-)<c(H+)<c(OH-)
参考答案:C
本题解析:因ROH为强碱,HM为弱酸,所以中和后生成强碱弱酸盐,水解显碱性,c(H+)<c(OH-)。但单水解程度一般较小,所以c(OH-)<c(M-),故选C。
本题难度:简单
5、选择题 下列说法正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
参考答案:D
本题解析:略
本题难度:一般