微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25 ℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述,正确的是

A.W点所示的溶液中:c(Na+)+c(H+)=2c( )+c(OH-)+c(Cl-)
)+c(OH-)+c(Cl-)
B.pH=4的溶液中:c(H2CO3)+c( )+c(
)+c( )<0.1 mol·L-1
)<0.1 mol·L-1
C.pH=8的溶液中:c(H+)+c(H2CO3)+c( )=c(OH-)+c(Cl-)
)=c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c( )>c(
)>c( )>c(H2CO3)
)>c(H2CO3)
参考答案:B
本题解析:对A项,根据电荷守恒知,c(Na+)+c(H+)=2c( )+c(
)+c( )+c(OH-)+c(Cl-),此时c(
)+c(OH-)+c(Cl-),此时c( )=c(
)=c( ),A错误;对B项,pH=4时,c(
),A错误;对B项,pH=4时,c( )=c(
)=c( )≈0,c(H2CO3)略大于0.02 mol·L-1,显然B正确;对C项,根据电荷守恒:c(Na+)+c(H+)=2c(
)≈0,c(H2CO3)略大于0.02 mol·L-1,显然B正确;对C项,根据电荷守恒:c(Na+)+c(H+)=2c( )+c(
)+c( )+c(OH-)+c(Cl-),根据物料守恒:c(Na+)=2c(H2CO3)+2c(
)+c(OH-)+c(Cl-),根据物料守恒:c(Na+)=2c(H2CO3)+2c( )+2c(
)+2c( ),可推出c(H+)+2c(H2CO3)+c(
),可推出c(H+)+2c(H2CO3)+c( )=c(OH-)+c(Cl-),C错误;对D项,c(
)=c(OH-)+c(Cl-),C错误;对D项,c( )最大时,Na2CO3与HCl是等物质的量(均为0.1 mol)反应的时刻(图中pH=8~9时),故pH=11时,HCl的物质的量远小于0.1 mol,而此时
)最大时,Na2CO3与HCl是等物质的量(均为0.1 mol)反应的时刻(图中pH=8~9时),故pH=11时,HCl的物质的量远小于0.1 mol,而此时 约为0.08 mol,故pH=11时,肯定是c(
约为0.08 mol,故pH=11时,肯定是c( )>c(Cl-),D错误。
)>c(Cl-),D错误。
本题难度:一般
2、选择题 我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A.有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
参考答案:D
本题解析:A、除去硫酸根的同时,引入了新的杂质硝酸根,错误;B、要得到钠和氯气需要电解熔融的NaCl,错误;C、增加氯离子的量,AgCl的沉淀溶解平衡向逆向移动,溶解度减小,错误;D、纯碱水解呈碱性,正确。
【考点定位】考查化学实验与化学反应基本原理,涉及除杂、沉淀溶解平衡、盐类水解等知识。
本题难度:一般
3、填空题 Na2SO3和NaClO两种钠盐分别溶于水后,溶液的pH均大于7,露置于空气中相当一段时间后(不考虑水分挥发)溶液pH都近似为7。这两种溶液呈碱性的原因分别是:_______________________、________________________(用离子方程式表示)。久置呈中性的原因是_____________________________________________________________________。
参考答案: +H2O
+H2O
 +OH-,ClO-+H2O====HClO+OH-
+OH-,ClO-+H2O====HClO+OH-
Na2SO3水解溶液呈碱性,久置于空气中,Na2SO3被氧化为Na2SO4,溶液呈中性;NaClO水解呈碱性,水解生成的HClO久置于空气中见光分解,NaClO溶液最终变为NaCl溶液,呈?中性。
本题解析:钠盐溶液pH大于7,一定是钠盐发生了水解,久置于空气中pH近似为7,则是弱酸强碱盐在空气中发生了化学反应转化为强酸强碱盐的缘故。
本题难度:简单
4、选择题 20℃时,两种一元弱酸的钠盐NaX和NaY,已知,往NaX溶液中 通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是(? )
通入CO2只能生成HX和NaHCO3;往NaY溶液中通入CO2能生成HY和Na2CO3,下列说法正确的是(? )
A.酸性HY>HX
B.结合H+的能力Y->CO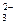 >X->HCO
>X->HCO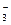
C.溶液的碱性:NaX>Na2CO3>NaY>NaHCO3
D.HX和HY酸性相同但比H2CO3弱
参考答案:B
本题解析:略
本题难度:一般
5、选择题 表示0.1mol/LNaHCO3溶液中有关微粒浓度大小的关系式,正确的是(?)
A.(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
B.(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
C.c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)
D.c(H+)>c(H2CO3)>c(OH-)>c(HCO3-)>c(CO32-)
参考答案:B
本题解析:NaHCO3中,溶液呈碱性,水解大于电离,故有Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);根据电荷守恒B正确。
本题难度:一般