|
高考化学知识点总结《离子共存》高频考点强化练习(2017年最新版)(十)
2017-08-01 02:40:03
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子在对应溶液中可能大量存在的是
A.水电离出的c(H+)=10-12mol·L-1的溶液:K+、Cu2+、SO32-、MnO4-
B.与铝粉反应能放出氢气的溶液:Na+、SO42-、HCO3-、Cl-
C.含有大量ClO-的溶液:H+、I-、SO42-、Cl-
D.pH=12的溶液:K+、Cl-、SO32-、SiO32-
|
参考答案:D
本题解析:A、水电离出的c(H+)=10-12mol·L-1的溶液,若pH=12呈碱性,A组中Cu2+离子不能共存;若pH=2呈酸性,A组中SO32-离子不能共存,故A错误。B、能与Al反应生成H2的溶液可能是酸性溶液也可能是碱性溶液,HCO3-均不能共存,所以B不正确。C、ClO-与H+、I-、均不能共存。故C错误。D、pH=12的溶液呈碱性K+、Cl-、SO32-、SiO32-均可存在,故D正确。
考点:认识离子共存,了解电离常数、盐的水解、Al的两性。
点评:判断离子是否共存的几种情况:1)能发生复分解反应,离子不能大量共存。 2)能发生氧化还原反应,离子不能大量共存 3)能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)4)溶液中能发生络合反应的离子不能大量共存。 同时要注意题目给出的附加条件,如:溶液的颜色、强酸性溶液(H+)、强碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-13mol/L的溶液,Ka的值等等。
本题难度:一般
2、填空题 Ⅰ把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中,有0.58g白色沉淀析出,向所得浊液中,逐滴加入1mol/L盐酸,加入盐酸的体积和生成沉淀的质量如图所示.
(1)混合物中NaOH的质量是______
(2)P点所表示盐酸的体积为______.
Ⅱ某待测液可能含有Ag+、Fe3+、K+、Ba2+、NH4+、SO42-、NO3-等离子,
进行如下实验:
①加入过量的稀盐酸,有白色沉淀生成.
②过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成.
③过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现.
④另取少量步骤③中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体.
根据实验现象回答:待测液中一定含有______离子,一定不含有______离子.
参考答案:Ⅰ:向所得浊液中,逐滴加入1mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:
①0-10ml,随盐酸的体积增加,生成沉淀的质量不变,说明沉淀是Mg(OH)2,m[Mg(OH)2]=0.58g,NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,NaOH有剩余,溶液是NaCl、NaAlO2和NaOH的混合液,该阶段发生反应是:NaOH+HCl=NaCl+H2O;
②10ml处,加入10ml盐酸刚好中和未反应的NaOH,溶液为NaCl、NaAlO2;
③10ml-30ml,随盐酸的体积增加,生成沉淀的质量增加,该阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
④30ml处,NaAlO2与盐酸恰好反应,需盐酸体积为:30ml-10ml=20ml,沉淀质量达到最大,溶液为NaCl溶液;
⑤30ml-p点,随盐酸的体积增加,沉淀的质量减少,发生反应是:Mg(OH)2+2HCl=MgCl2+2H2O;
Al(OH)3+3 HCl=AlCl3+3H2O;
⑥p点,Mg(OH)2和Al(OH)3完全反应,溶液为MgCl2、AlCl3和NaCl混合液.
选30ml处,计算NaOH的质量,此时,溶液为NaCl溶液,溶液中Cl-来源于原混合物中的AlCl3、MgCl2和加入的30mlHCl,溶液中Na+来源于原混合物中的NaOH.
? NaAlO2 +HCl+H2O=Al(OH)3↓+NaCl
? 0.02mol?0.02L×1mol/L=0.02mol?
由Al原子守恒得原混合物中n(AlCl3)=n(NaAlO2)=0.02mol
由Mg原子守恒得原混合物中n(MgCl2)=n[Mg(OH)2]=0.58g58g/mol=0.01mol,
由Na+离子和Cl-离子守恒得:
n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.01mol×2+0.02mol×3+0.03L×1mol/L=0.11mol
所以,原混合物中NaOH的质量:m(NaOH)=0.11mol×40g/mol=4.4g
P点溶液为MgCl2、AlCl3和NaCl混合液,P点所加盐酸相等于用于中和原混合物中的NaOH,此时所加盐酸物质的量:
n(HCl)=n(NaOH)=0.11mol;P点所表示盐酸的体积为:V=0.11mol1mol/L=0.11L=110ml
故答案为:(1)4.4g(2)110ml
Ⅱ:某待测液可能含有Ag+、Fe3+、K+、Ba2+、NH4+、SO42-、NO3-等离子,进行如下实验:
①加入过量的稀盐酸,有白色沉淀生成.说明原溶液中一定含有Ag+;一定不含SO42-,因为Ag+与SO42-结合成微溶物
Ag2SO4,溶液呈电中性,一定还含有NO3-.
②过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成.说明原溶液中一定含有Ba2+;
③过滤,取少量滤液,滴入2滴KSCN溶液,没有明显的现象出现.说明原溶液中一定没有Fe3+;
④另取少量步骤③中的滤液,加入NaOH溶液至使溶液呈碱性,加热,可产生使湿润的红色石蕊试纸变蓝色的气体.说明原溶液中一定含有NH4+;
K+无法确定,可通过焰色反应(透过蓝色钴玻璃)进一步确定.
故答案为:Ag+、Ba2+、NH4+、NO3-;? SO42-、Fe3+
本题解析:
本题难度:简单
3、选择题 下列叙述正确的是
[? ]
A.可以根据PbI2和AgCl的Ksp的大小比较两者的溶解能力
B.常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大
C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大
D.能使碘化钾淀粉试纸变蓝的溶液中,Na+、S2-、Br-、NH4+等离子可以大量存在
参考答案:C
本题解析:
本题难度:一般
4、填空题 常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3—、SO42—、CO32—,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题。
(1)五种盐中,一定没有的阳离子是____________;所含阴离子相同的两种盐的化学式是________________。
(2)D的化学式为______________,D溶液显碱性的原因是(用离子方程式表示)__________________________________________。
(3)A和C的溶液反应的离子方程式是_________________________;E和氨水反应的离子方程式是____________________。
(4)若要检验B中所含的阳离子,正确的实验方法是________________。
参考答案:(1)Cu2+、Fe3+ (NH4) 2SO4、Al2(SO4)3
(2)Na2CO3 CO32—+H2O HCO3—+OH- HCO3—+OH-
(3)Ag++Cl-===AgCl↓
Al3++3NH3·H2O===Al(OH)3↓+3NH4+
(4)取少量B于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸放在试管口,观察是否变蓝色
本题解析:由于盐溶液没有颜色,所以没有Cu2+和Fe3+;根据实验现象可知,A、B、C、D、E分别为BaCl2、(NH4)2SO4、AgNO3、Na2CO3、Al2(SO4)3;检验NH4+,常用的方法是将铵盐与浓NaOH溶液共热,看是否能够产生使湿润的红色石蕊试纸变蓝的气体。
本题难度:一般
5、选择题 25℃,在20 mL 0.1mol/L 氨水溶液中逐滴加入0.2mol/L HCl溶液(如图),下列说法正确的是
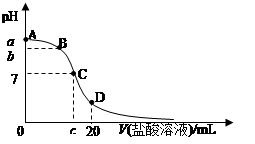
A.在A、C间任一点,溶液中一定都有:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
B.在C点,c<10,且有c(NH4+)=c(Cl—)=c(OH-)=c(H+)
C.若25℃ 0.1mol/L 氨水电离度为1.33%,则b<a<12
D.在D点:2c(NH4+)+2c(NH3·H2O)=c(Cl—)
参考答案:CD
本题解析:根据图像可知,在A、C间任一点,溶液都显碱性,但氯离子浓度不一定大于c(OH—),A不正确;C点溶液显中性,根据电荷守恒可知,c(NH4+)=c(Cl—)>c(OH-)=c(H+),B不正确;25℃ 0.1mol/L 氨水电离度为1.33%,则氨水溶液中c(OH—)=1.33×10-3mol/L,则此氨水溶液的pH大于12,C正确;D溶液中的溶质是氯化铵和氯化氢,且二者的物质的量相等,所以根据物料守恒可知选项D正确,答案选CD。
点评:该题是高考中的常见题型,属于综合性试题的考查,对学生的思维能力提出了较高的要求,本题贴近高考,综合性强,侧重对学生能力的培养,意在培养学生的逻辑推理能力和创新思维能力。该题的关键是在明确反应原理的基础上利用好几种守恒关系,即电荷守恒、物料守恒以及质子守恒,然后结合图像和题意灵活运用即可。
本题难度:一般
|