微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列各组离子在指定溶液中能大量共存的是(?)
A.加入铝粉产生H2的溶液中:Fe2+、Na+、SO42-、ClO-
B.滴入酚酞显红色的溶液中:NH4+、Mg2+、AlO2-、NO3-
C.pH=1的溶液中:Fe3+、Cl-、NO3-、K+
D.c(SO32-)=0.1 mol·L-1的溶液中:Ca2+、MnO4-、SO42-、H+
参考答案:C
本题解析:A错,Fe2+、与ClO-本身不能共存,会发生氧化还原反应;B错,滴入酚酞显红色的溶液为碱性溶液,NH4+、Mg2+不能共存;C正确;D错,MnO4-、H+具有强氧化性,能氧化SO32-离子;
本题难度:一般
2、选择题 某溶液中含有NO、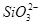 、
、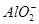 、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
、S2-4种离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
A.只有S2-
B.S2-和NO3-
C.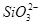 、S2-和NO3-
、S2-和NO3-
D.4种离子都减少
参考答案:B
本题解析:本题通过实验探究4种离子的反应情况,考查离子反应的本质。解答时根据H+、Cl-、Na+、OH-与4种离子的性质,推断出离子数目大量减少的离子。加入过量盐酸,NO3- (H+)氧化S2-,从而导致 NO3-和S2-的数目大量减少,而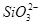 、
、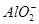 与过量的H+反应生成H2SiO3、Al3+,H2SiO3、Al3+分别与过量的OH-反应又生成
与过量的H+反应生成H2SiO3、Al3+,H2SiO3、Al3+分别与过量的OH-反应又生成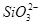 和
和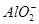 ,数目几乎不变。
,数目几乎不变。
本题难度:一般
3、填空题 (14分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为_______。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表示)______________? , ______________ ,? _______________。
(3)以下各小题均为常温下的溶液
j某溶液中由水电离的c(H+)=10-10mol·L-1,则该溶液的pH为__________。
k盐类水解的逆反应是中和反应?(填“对”或“错”)
lHCO3—溶液呈碱性说明HCO3—的电离能力弱于水解能力?(填“对”或“错”)
m盐溶液显酸碱性,一定是由水解引起的?(填“对”或“错”)
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)  Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:①100 ml蒸馏水 ②100 mL 0.3 mol·lL-1 AgNO3溶液 ③100 mL 0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为_______________(填序号),此时溶液②中Cl-物质的量浓度为__________________。
参考答案:(1)c(NH4+)>c(SO42—)>c(H+)>c(OH-)
(2)HCO3— H++CO32—;HCO3—+H2O
H++CO32—;HCO3—+H2O H2CO3+OH-;H2O
H2CO3+OH-;H2O H++OH-
H++OH-
(3) 4或10 ,对,对,错? (4)②①③? 6×10-10mol·L-1
本题解析:(1)硫酸铵是强酸弱碱盐,NH4+水解,溶液显酸性,所以离子浓度大小顺序是c(NH4+)>c(SO42—)>c(H+)>c(OH-)。
(2)碳酸氢钠是弱酸的酸式盐,存在电离平衡、水解平衡以及水的电离平衡,即HCO3— H++CO32—;HCO3—+H2O
H++CO32—;HCO3—+H2O H2CO3+OH-;H2O
H2CO3+OH-;H2O H++OH-。
H++OH-。
(3)①某溶液中由水电离的c(H+)=10-10mol·L-1,则该溶液中水的电离是被抑制的,因此可能是酸或碱,因此溶液的pH=4或10。
②盐类水解可以看作是中和反应的逆反应。
③HCO3—的水解程度大于HCO3—的电离程度,所以碳酸氢钠溶液显碱性。
④硫酸氢钠溶于水电离出氢离子,溶液显酸性,但硫酸氢钠不水解,所以盐溶液显酸碱性,一定是由水解引起的,是错误的。
(4)根据氯化银的溶度积常数可知,氯离子浓度越大,银离子浓度就越小,所以Ag+浓度由大到小的顺序为②①③。Ag+浓度是0.3mol/L,所以氯离子浓度是1.8×10-10÷0.3=6×10-10mol·L-1。
点评:化学平衡、电离平衡、水解平衡、溶解平衡等都是动态平衡,适用于勒夏特例原理,据此可以进行有关判断。
本题难度:困难
4、选择题 能在无色溶液中大量共存的一组离子是
A.Cu2+、SO42—、OH—、K+
B.Fe3+、Cl—、NO3—、H+
C.K+、CO32—、Cl—、H+
D.H+、Na+、Cl—、SO42—
参考答案:D
本题解析:A.Cu2+有色,且Cu2+与OH—反应;B.Fe3+有色;C.CO32—与H+反应;D.H+、Na+、Cl—、SO42—共存。
本题难度:一般
5、选择题 在水溶液中能大量共存的一组离子是( )
A.Al3+、Na+、HCO3-、SO42-
B.H+、Fe2+、ClO-、Cl-
C.Mg2+、K+、SO42?、NO3-
D.NH4+?Ag+、OH-、Br-
参考答案:A.Al3+与HCO3-发生互促水解反应而不能大量共存,故A错误;
B.酸性条件下Fe2+与ClO-发生氧化还原反应而不能大量共存,故B错误;
C.离子之间不发生任何反应,可大量共存,故C正确;
D.NH4+与OH-、Ag+与Br-反应而不能大量共存,故D错误.
故选C.
本题解析:
本题难度:一般