微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+ O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+ O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。
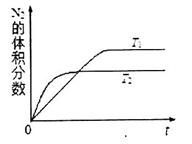
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。

①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃 料电池,可用作电解池的电源。其工作原理如图所示

①写出a极上的电极反应式: ,
②正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为
参考答案:(1)① > (1分) ②0.01mol·L-1·s-1 (1分)(其它每空2分) 14.3%
(2)①SO2 + 2H2O
本题解析:
本题难度:困难
2、选择题 下列备装置中电流表有电流通过的是
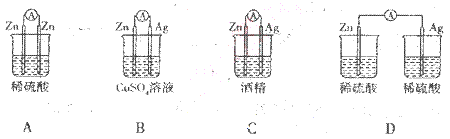
参考答案:B
本题解析:A、电极均是Zn,不能形成电流,错误;B、Zn与硫酸铜溶液发生置换反应,且是闭合回路,所以可以形成原电池,有电流通过,正确;C、酒精是非电解质溶液,不能导电,所以没有电流通过,错误;D、未形成闭合回路,不能形成原电池,没有电流通过,错误,答案选B。
考点:考查原电池的构成条件
本题难度:一般
3、选择题 下列说法不正确的是
A.铅蓄电池在放电过程中,正负极质量均增加
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H> O
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小
D.将浓度为0.1mol·L-1的HF溶液加水不断稀释, 的值始终保持增大
的值始终保持增大
参考答案:C
本题解析:铅蓄电池在放电过程中,正极反应式是Pb-2e-+SO42-=PbSO4↓,负极反应式PbO2+2e-+4H++ SO42-=+2H2O+ PbSO4,A正确;反应C(s)+CO2(g)=2CO(g)需在高温下才能进行,根据吉布斯自由能G =" H" – TS,可知B正确;Ksp只与温度有关,C错误;HF溶液加水不断稀释,电离平衡常数K=,因为K不变,[F-]不断减小,故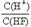 的值始终保持增大,D正确。
的值始终保持增大,D正确。
点评:《化学反应原理》一书是高考的重难点,考生在备考过程中应注意抓住各章节的重点,通过常见的考题,学会灵活分析应用。
本题难度:一般
4、填空题 如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的______棒,乙装置中的______棒.
②乙装置中阳极的电极反应式是:______.
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:______.
②甲装置中碳极的电极反应式是______,乙装置碳极的电极反应属于______(填“氧化反应”或“还原反应”).
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:______.
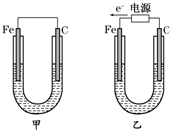
参考答案:(1)①甲为原电池,Fe为负极,发生Fe+CuSO4═FeSO4+Cu,所以碳电极上生成红色物质Cu,乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,故答案为:碳;铁;
②乙中阳极上氢氧根离子放电,电极反应为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)①电解NaCl溶液生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O电解.Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O电解.Cl2↑+H2↑+2OH-;
②甲中碳为正极,正极上氧气得电子发生还原反应,电极反应为2H2O+O2+4e-═4OH-,乙中碳为阳极,发生氧化反应,故答案为:2H2O+O2+4e-═4OH-;氧化反应;
③碳电极为阳极,阳极上生成氯气,氯气和碘离子发生置换反应生成碘,碘遇淀粉试液变蓝色,故答案为:在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝.
本题解析:
本题难度:简单
5、选择题 某种锂电池的总反应可表示为:Li+MnO2=LiMnO2若该电池提供9.6库仑(C)电量(忽略损耗),则消耗的正极材料的质量约为(电子电量取1.60×10-19 C)
A.7×10-3 g
B.8.7×10-3 g
C.9.6×10-3 g
D.4.5×10-3g
参考答案:B
本题解析:
本题难度:一般