微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某元素最高正价氧化物对应的水化物的化学式是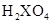 ,这种元素的气态氢化物的化学式为(?)
,这种元素的气态氢化物的化学式为(?)
A.HX? B 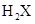 ?C
?C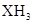 ? D.
? D.
参考答案:B
本题解析:非金属元素的最高正化合价与它的负化合价的绝对值之和等于8,由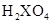 可以推算出该元素的最高正化合价为+6,故其负化合价为-2,气态氢化物的化学式应为
可以推算出该元素的最高正化合价为+6,故其负化合价为-2,气态氢化物的化学式应为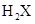 ,故选B
,故选B
点评:考查元素周期律的内容,难度不大,需掌握元素周期表的基本结构以及前20号元素的原子结构。
本题难度:简单
2、选择题 下列各组顺序的排列不正确的是(? )
A.酸性强弱:HClO4>H2SO4>H3PO4
B.离子半径:Na+>Mg2+>Al3+>F-
C.热稳定性:HCl>H2S>PH3>SiH4
D.碱性强弱: KOH > NaOH > LiOH
参考答案:B
本题解析:非金属性越强,最高价氧化物的水化物的酸性就越强,相应氢化物的稳定性就越强。非金属性是Cl>S>P>Si,所以A、C正确。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,B不正确,顺序应该是F->Na+>Mg2+>Al3+。金属性越强,最高价氧化物的水化物的碱性就越强。金属性是K>Na>Li,所以选项D也正确。答案选B。
本题难度:一般
3、选择题 可能存在的第119号未知元素,有人称为“类钫”,根据元素周期表结构及性质变化趋势,判断有关“类钫”的预测正确的是
A.具有放射性
B.单质有较高的熔点
C.在化合物中呈+2价
D.单质的密度小于1 g/cm3
参考答案:A
本题解析:A、119号元素位于第八周期第IA,所以具有放射性,A正确;B、碱金属单质自上而下熔点逐渐降低,B不正确;C、碱金属元素的最外层电子数是1个,在化合物中显+1价,C不正确;D、碱金属单质的密度自上而下逐渐增大,所以密度大于1g/cm3,D不正确,答案选A。
本题难度:一般
4、填空题 X、Y、Z、W四种短周期元素在元素周期表的位置如图。其中W的原子序数是Y的2倍。
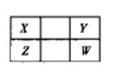
(1)W离子的结构示意图为____________。
(2)X的最简单氢化物与Cl2发生取代反应的化学方程式为(写一个)________________。
(3)能证明X、Z两元素非金属性强弱的离子方程式为__________________________。
(4)一定条件下,在密闭容器中,充入一定量的XY2(g)和XY (g),发生反应:
WY2(g)+2XY(g) 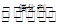 2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:
2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:

②若温度升高到T2oC时,反应的平衡常数为6.64,则该反应的正反应为_______反应(填 “吸热”或“放热”)。
(5)① 25℃、101 kPa,l mol金属镁完全燃烧放出300.0 kJ热量,1 mol单质X完全燃烧放出393.5 kJ热量。金属镁与X的最高价氧化物反应的热化学方程式为_________。
②室温下,Mg(OH) 2饱和溶液_________(填“能”或“不能”)使酚酞试液变红,通过计算说明原因(已知:Ksp[Mg(OH) 2]=4.0×10-12)。答__________________________
参考答案:
(1)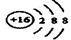
(2)CH4 + Cl2 →? CH3Cl+HCl
(3)CO2+SiO32-+H2O= CO32-+H2SiO3↓
(4)吸热
(5)2Mg(s)+ CO2(g) =" 2MgO(s)+C(s)" △H=-206.5kJ/mol
(6)能? Ksp[Mg(OH)2]=4.0×10-12=c(Mg2+)×c2(OH-)?
1/2c3(OH-)= 4.0×10-12
?c(OH-) =2.0×10-4
pOH=3.7?
pH=14-3.7=10.3?
酚酞的变色范围为8.2——10,故变红。
本题解析:W、Y同主族,且W的原子序数是Y的2倍,只有O、S符合,X、Y、Z、W分别为C、O、Si、S。(2)X的最简单氢化物为甲烷,甲烷与氯气发生取代反应,生成CH3Cl、CH2Cl2、CHCl3、CCl4;(3)比较元素非金属性强弱可以根据最高价氧化物对应水化物酸性、与氢气化合的能力、氢化物稳定性及单质的置换反应;能证明X、Z两元素非金属性强弱的反应可以从强酸制弱酸和常温条件下的单质置换反应处理,本题可根据碳酸生成硅酸得出结论;
(4)该条件下平衡常数k=c2(XY2)/ c2(XY) c(WY2)=4.44<6.64,升高温度平衡正向移动,反应吸热;
(5)①Mg(s)+1/2O2(g)=" MgO(s)" △H="-300.0" kJ/mol
②C(s)+O2(g)= CO2(g) △H="-393.5" kJ/mol
①×2-②得出2Mg(s)+ CO2(g) =" 2MgO(s)+C(s)" △H=-206.5kJ/mol
②Ksp[Mg(OH)2]=4.0×10-12=c(Mg2+)×c2(OH-)? 1/2c3(OH-)= 4.0×10-12?c(OH-) =2.0×10-4
pOH=3.7? pH=14-3.7=10.3?酚酞的变色范围为8.2——10,故变红。
本题难度:一般
5、选择题 右图中a、b、c、d、e、f为元素周期表中前4周期的相邻的一部分元素,下列有关叙述正确的是
?
| ?
| ?
| ?
| a
|
?
| ?
| b
| c
| ?
|
d
| e
| ?
| ?
| ?
|
?
| ?
| ?
| f
| ?
A.b、c、d 三种元素的原子半径大小关系:d> c> b
B.六种元素中,d元素的性质最稳定
C.c和f的气态氢化物,前者比后者稳定
D.e元素的最高价氧化物的水化物是二元酸
|
题型:单选题难度:偏易来源:不详 答案 马上分享给同学