|
高考化学知识点总结《物质的量》考点特训(2017年冲刺版)(二)
2017-08-06 08:45:44
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 若NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,6.72LNO2与水充分反应转移电子数为0.1NA
B.18gD2O中含有的质子数目为10NA
C.常温常压下,1mol氦气中含有的核外电子数为2NA
D.ag某气体含分子数为b,cg该气体在标况下的体积为22.4ab/(c NA) L。
|
参考答案:C
本题解析:A.标准状况下,6.72LNO2与水充分反应转移电子数为0.2NA ,错误;B.18gD2O的物质的量小于1mol,所以其中含有的质子数目小于10NA ,错误;C.He是单原子分子,常温常压下,1mol氦气中含有的核外电子数为2NA,正确;D.ag某气体含分子数为b,cg该气体含有的分子数是bc/a,则其物质的量是bc/aNA,在标况下的体积为22.4b c /( aNA) L。错误。
考点:考查阿伏加德罗常数的计算的知识。
本题难度:一般
2、实验题 为验证Cl2、Br2的氧化性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如下图,填写图中的空白。

(1)2 mL 试剂 ;加入少量 试剂;再加入
试剂; 现象: 。
(2)可以证明Cl2的氧化性____________(填“强于”或“弱于”)Br2的氧化性;氯元素的非金属性 ____________(填“强于”或“弱于”)_溴元素的非金属性。
( 3 )此反应的离子方程式为:________________________________________。
(4)某溶液中Cl-、Br-、I-的物质的量之比为4∶1∶4,要使溶液中的Cl-、Br-、I-的物质的量之比变为7∶1∶1,则通入Cl2的物质的量与原溶液中I-的物质的量之比为______。
参考答案:(1)NaBr溶液 ; 氯水 ; 四氯化碳 ; 分成两层 上层无色、下层棕红色(或橙色或橙红色) 。
(2)强于;强于(3)Cl2+2Br-=2Cl-+Br2
(4)3:8
本题解析:(1)验证Cl2、Br2的氧化性强弱,结合题干提供的试剂,可知第一支试管应该装的是2mLNaBr溶液,第二支试管中加入氯水,振荡之后再加入CCl4把置换出来的Br2从混合液中萃取出来,混合液分成两层,上层为NaCl溶液无色,下层Br2和CCl4,呈棕红色(或橙色或橙红色)。
(2)由实验证明Cl2的氧化性强于Br2的氧化性,结合元素周期律,也可得氯元素的非金属性强于溴元素的非金属性。该反应的离子方程式为:Cl2+2Br-=2Cl-+Br2 。
(4)依题意,可设原溶液中Cl-、Br-、I-的物质的量为4X、X、4X,反应后溶液中的Cl-、Br-、I-的物质的量为7X、X、X,通入氯气后,发生如下反应:Cl2+2I-=2Cl-+I2,可知I-的减少量为Cl2通入量的2倍,则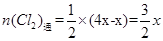 , , 。 。
考点:化学实验,卤素的化学性质,物质的量计算。
点评:探究式实验是近年来高考的热点,重在培养学生的发散性思维,逻辑思维能力,本题难度不大,解题的关键是要掌握卤素的化学性质和反应方程式的正确书写,结合反应原理,题干信息,巧妙假设,化繁为简。
本题难度:困难
3、计算题 实验室加热氯酸钾(KClO3)和二氧化锰(作催化剂)的混合物制取氧气(同时生成KCl)。若收集到标准状况下3.36L氧气,至少需要多少克氯酸钾?同时生成氯化钾的物质的量为多少?
参考答案:12.25g(12.3g)? 0.1
本题解析:解:设需要氯酸钾的质量为x,则
2KClO3?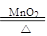 ?2KCl?+? 3O2↑ ?2KCl?+? 3O2↑
245? 96
X? 3.36/22.4×32=4.8g?
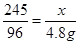 ?解得x=12.25g ?解得x=12.25g
设生成氯化钾的物质的量为a,则
2KClO3?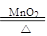 ?2KCl?+? 3O2↑ ?2KCl?+? 3O2↑
2?3
a?3.36/22.4="0.15" mol
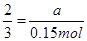 ?解得a=0.1mol? ?解得a=0.1mol?
点评:本题考查了利用化学方程式的简单计算,物质的量的计算,本题难度不大。
本题难度:一般
4、选择题 下列说法中正确的是( )
A.KOH的摩尔质量是56 g
B.一个碳原子的质量就是其相对原子质量
C.硫原子的质量就是硫的相对原子质量
D.氦气的摩尔质量(单位:g·mol-1)在数值上等于它的相对原子质量
参考答案:D
本题解析:摩尔质量的单位是g/mol,选项A不正确;原子的实际质量与1个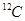 质量的1/12的比值,就是该原子的相对原子质量,选项B、C都是不正确的,选项D正确,答案选D。 质量的1/12的比值,就是该原子的相对原子质量,选项B、C都是不正确的,选项D正确,答案选D。
本题难度:简单
5、填空题 (4*2分)(1)写出 CO与氧化铜反应的化学方程式并标明电子转移的方向和数目。
(2)2.8gCO的物质的量为 mol,含有 个原子,
完全与氧化铜反应时失去电子 mol。
参考答案:
(1)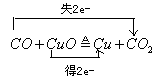 (2)0.1 1.204×1023 0.2 (2)0.1 1.204×1023 0.2
本题解析:(1)一氧化碳与氧化铜反应时,碳元素化合价升高,失去2个电子,铜元素化合价降低,得到2个电子。(2)2.8克一氧化碳的物质的量为2.8÷28=0.1摩尔,含有0.2摩尔原子,0.2×6.02×1023=1.204×1023个原子,完全与氧化铜反应时失去电子0.2摩尔。
考点:氧化还原反应,电子转移。
本题难度:一般
|