微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NA代表阿伏加德罗常数,下列说法中正确的是
A.标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA
B.密闭容器中,0.1 mol H2和25.4 g碘在一定条件下充分反应,生成HI分子数为0.2 NA
C.含有4 NA个碳碳σ键的金刚石,其质量为24 g
D.含0.1 mol FeCl3的溶液完全水解后得到的胶体粒子个数为0.1 NA
参考答案:C
本题解析:A.由于氯气完全溶于1 L水中时只有一部分氯气发生反应,产生的所以HClO是弱酸,所以所得溶液中Cl-和ClO-两种粒子数之和小于NA。错误。B.n(I2)=25.4g÷254g/mol=0.1mol.但是H2和碘在一定条件下发生的反应是可逆反应,反应物不能完全转化为生成物,所以生成HI分子数小于0.2 NA。错误。C.在金刚石中每个C原子与其它的C原子形成四个共价键,每个共价键是两个C原子形成的。所以属于每个C原子的共价键为4÷2=2.所以含有4 NA个碳碳σ键的金刚石中的C原子为2mol,因此其质量为24g.正确。D. 含0.1 mol FeCl3的溶液中,Fe3+水解的程度是很微弱的,所以水解后得到的胶体粒子个数少于0.1 NA。错误。
本题难度:一般
2、选择题 在t℃时,将a?gNH3完全溶解于水,得V?mL饱和溶液,测得该溶液的密度为ρg/cm3,质量分数为ω,其中n(NH4+)?为b?mol.则下列叙述中错误的是( )
A.溶液中C(OH-)=
mol/L
B.溶质的物质的量浓度C=mol/L
C.溶质的质量分数:ω=×100%
D.上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5ω
参考答案:A、V?mL饱和溶液中n(OH-)=n(H+)+n(NH4+)=[c(H+)×10-3+b]mol,所以c(OH-)=[c(H+)×V×10-3+b]molV×10-3L=1000b+c(H+)VV,故A正确;
B、氨气的物质的量为ag17g/mol=a17mol,所以溶质的物质的量浓度为a17molV×10-3L=1000a17Vmol/L,故B正确;
C、溶液质量为Vml×ρg/ml=ρVg,所以溶质的质量分数为agρVg×100%=100aρV%,故C错误;
D、混合前后溶质的质量不变为ag,水的密度比氨水的密度大,即ρg/cm3<ρ水,等体积Vml混合,混合后溶液的质量大于2ρvg,所以混合后质量分数小于小于0.5ω,故D正确.
故选:B.
本题解析:
本题难度:一般
3、计算题 在标准状况下,CO和CO2的混合气体15g所占的体积为11.2L,则;
(1)混合气体的摩尔质量是 (2) CO和CO2两气体的体积比
参考答案:30g /mol 7:1
本题解析:(1)标准状况下,11.2L气体是11.2L÷22.4L/mol=0.5mol
所以混合气的平均摩尔质量是15g÷0.5mol=30g/mol
(2)设CO和CO2两气体的物质的量分别是x、y
则x+y=0.5mol、28x+44y=15g
解得x
本题难度:一般
4、选择题 13.9g XSO4·nH2O晶体,完全失水后,剩余7.6g粉末,若X的原子量为结晶水分子数的8倍,则X的原子量为
A.23
B.27
C.40
D.56
参考答案:D
本题解析:根据题意可知,结晶水的质量是13.9g-7.6g=6.3g,物质的量是0.35mol,所以有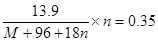 ,又因为8n=M,所以解得M=56,答案选D。
,又因为8n=M,所以解得M=56,答案选D。
本题难度:简单
5、选择题 某盐的混合溶液中含有0.2mol/L?Na+、0.4mol/L?Mg2+、0.4mol/L?Cl-,则SO42-的浓度为( )
A.0.1mol/L
B.0.5mol/L
C.0.3mol/L
D.0.15mol/L
参考答案:溶液呈电中性,根据电荷守恒,则有c(Na+)+2c(Mg2+)+c(H+)=c(Cl-)+2c(SO42-)+c(OH-),
该溶液为强酸和强碱形成的盐溶液,则溶液呈中性,即c(H+)=c(OH-),
所以c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),
则c(SO42-)=0.2mol/L+2×0.4mol/L-0.4mol/L2=0.3mol/L,
故选C.
本题解析:
本题难度:简单