微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有如下转化关系(其他产物及反应所需条件均已略去)。
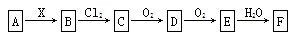
以下推断错误的是( )
A.当X是盐酸时,则F是稀硝酸
B.当X是氢氧化钠时,则F是稀硝酸
C.当X是氢氧化钠时,B跟Cl2反应可能有白烟现象
D.当X是氢氧化钠时,B能使酸性高锰酸钾溶液褪色
参考答案:A
本题解析:B项,NH4Cl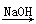 NH3
NH3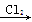 N2
N2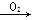 NO
NO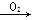 NO2
NO2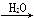 HNO3;C项,8NH3+3Cl2=6NH4Cl+N2产生白烟;D项,H2S
HNO3;C项,8NH3+3Cl2=6NH4Cl+N2产生白烟;D项,H2S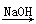 Na2S
Na2S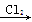 S
S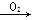 SO2O2,SO3
SO2O2,SO3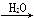 H2SO4,Na2S能被酸性KMnO4溶液氧化。
H2SO4,Na2S能被酸性KMnO4溶液氧化。
本题难度:一般
2、选择题 下列性质对氧族元素(O、S、Se、Te)和卤族元素(F、Cl、Br、I)均无例外的是(?)
A.氢化物水溶液均呈酸性
B.都存在含氧酸,都能表现+6价或+7价
C.除氧外均可在一定条件下得到氧化物
D.其单质均可与钠作用
参考答案:D
本题解析:O的氢化物H2O为中性;F、O不存在含氧酸;O、F不存在氧化物。
本题难度:简单
3、选择题 不能由单质直接与O2反应生成的氧化物是(?)
A.Fe3O4
B.SO3
C.CO2
D.CuO
参考答案:B
本题解析:单质S直接与O2反应生成SO2,而不是SO3,故B错误;
本题难度:简单
4、选择题 用浓硫酸吸收SO3可得到H2SO4·SO3,若用1 kg 98%的浓H2SO4充分吸收SO3后,再进行稀释,可得到98%的硫酸的质量为
A.1.98 kg
B.2.00 kg
C.2.22 kg
D.2.42 kg
参考答案:C
本题解析:1 kg 98%的浓H2SO4中含H2SO4的物质的量为n(H2SO4)="10" mol,水的物质的量n(H2O)=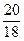 mol=
mol=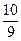 mol,转化为H2SO4的物质的量为
mol,转化为H2SO4的物质的量为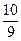 mol,完全吸收SO3后再稀释得到的总H2SO4的物质的量为(10+
mol,完全吸收SO3后再稀释得到的总H2SO4的物质的量为(10+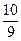 )×2 mol。根据题意,假设稀释后的溶液的质量为x,则有(10+
)×2 mol。根据题意,假设稀释后的溶液的质量为x,则有(10+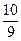 )×2 mol×98 g·mol-1=98%·x 解之得x=" 2220" g。
)×2 mol×98 g·mol-1=98%·x 解之得x=" 2220" g。
本题难度:简单
5、实验题 (18分)某同学用如下图1所示的装置来探究SO2的性质及有关实验。
(1)实验前应先检验装置的气密性,方法是?
(2)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,写出该反应的化学方程式
?。
(3)分别将SO2气体通入气体下列C溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液,现象是?,继续通入过量的SO2气体,现象是?。
②SO2通入紫红色KMnO4溶液,现象是?,
③SO2慢慢通入澄清石灰水中,现象?。
(4)若同学制取的SO2气体中混有CO2气体,请你设计实验证明混合气体中既有SO2气体,又有CO2气体。可以选择下图2洗气装置设计实验。洗气装置里的溶液是:
A浓硫酸、B氢氧化钠溶液、C硫酸铜溶液、D品红溶液、
E澄清石灰水、F高锰酸钾溶液、G碳酸氢钠溶液。
上述装置的所装试剂连接顺序是(用字母表示,所给装置可以重复使用,有些装置也可以不用)?。
参考答案:(1)关闭分液漏斗的活塞,用双手(或热毛巾)握住B,C?中有气泡产生,移开双手,C中导管形成一段水柱,说明不漏气。(3分)
(2)Na2SO3+H2SO4=Na2SO4+SO2↑+H2O(3分)
(3)①紫色溶液变为红色?红色不褪去(或溶液颜色无变化)(3分)
②紫红色褪去?(3分)
③首先有白色沉淀生成,然后白色沉淀消失(3分)
(4)D、F、D、E或D、F、F、E(其它顺序合理也给分)(3分)
本题解析:(1)检验气密性的方法是,首先关闭分液漏斗的活塞,然后用双手(或热毛巾)握住B,C中有气泡产生,移开双手,C中导管形成一段水柱,说明不漏气。
(2)硫酸的酸性强于亚硫酸的,因此硫酸和亚硫酸钠反应,生成硫酸钠、SO2和水。反应式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。
(3)①SO2溶于水生成亚硫酸,溶液显酸性,所以溶液显红色。由于SO2的漂白不能使酸碱指示剂褪色,所以继续通入SO2,溶液的颜色也不会变化。
②SO2具有还原性,高锰酸钾溶液具有氧化性,二者发生氧化还原反应,所以溶液的紫红色会褪去。
③SO2是酸性氧化物,和氢氧化钙反应生成亚硫酸钙白色沉淀和水。继续通入SO2,白色沉淀逐渐消失而溶解。
(4)检验SO2一般用品红溶液,检验CO2一般用澄清的石灰水。但由于SO2也能是澄清的石灰水变混浊,所以显检验SO2,且在通入澄清的石灰水之前,还应除去SO2,为了防止SO2除不尽,还需要再次透过品红溶液,来检验SO2是否完全被除尽。所以正确的答案是D、F、D、E或D、F、F、E。
本题难度:一般