微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于浓、稀H2SO4的叙述正确的是(?)
A.浓H2SO4、稀H2SO4都难挥发
B.浓H2SO4、稀H2SO4都有氧化性,故浓、稀H2SO4都是氧化性酸
C.浓H2SO4、稀H2SO4在加热时都能与铜反应
D.浓H2SO4、稀H2SO4在常温下都能用铁制容器储存
参考答案:A
本题解析:浓、稀H2SO4的性质对比要清楚。
本题难度:简单
2、选择题 某同学利用下列装置进行浓硫酸和铜反应并验证二氧化硫的性质。按如图实验装置连接仪器和放置药品。加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出。实验结束后会看到两个试管的液体底部均有少量的白色固体。下列对该实验的现象分析或推断正确的是

A.湿润的蓝色石蕊试纸先变红后褪色
B.左边试管出现的白色固体是由于浓硫酸的脱水性所致
C.从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应
D.本实验体现了二氧化硫的酸性、漂白性和弱氧化性
参考答案:C
本题解析:A、SO2不能漂泊石蕊,所以蓝色石蕊试纸变红,不会褪色,错误;B、Cu与浓硫酸反应生成CuSO4,左边试管出现的白色固体为无水CuSO4,错误;C、加热浓硫酸约1分钟后撤去酒精灯,反应继续进行,说明铜与浓硫酸的反应是放热反应,正确;D、湿润的蓝色石蕊试纸变红,体现了SO2溶于水后显酸性,吸有品红溶液的滤纸褪色,体现了SO2的漂白性,但本实验无法证明二氧化硫的弱氧化性,错误。2的性质。
本题难度:一般
3、选择题 已知0.1mol某单质与足量的硫在一定条件下充分反应后,质量增加了1.6g,则该单质可能是(? )
A.钙
B.铜
C.铁
D.铝
参考答案:B
本题解析:增加的质量就是硫的质量,即单质硫是1.6g,得到电子是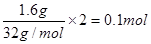 。根据电子的得失守恒可知0.1mol金属就失去0.1mol电子,即金属的化合价是+1价,所以是金属铜,答案选B。
。根据电子的得失守恒可知0.1mol金属就失去0.1mol电子,即金属的化合价是+1价,所以是金属铜,答案选B。
本题难度:简单
4、选择题 已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是

A.X使蔗糖变黑的现象主要体现了X的脱水性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到白色沉淀产生
D.工业上,B转化为D的反应条件为高温、高压、使用催化剂
参考答案:A
本题解析:X为浓硫酸,使蔗糖变黑主要体现了浓硫酸的脱水性;常温下铁遇到浓硫酸会钝化;若A为碳,则C为CO2,过量的CO2通入澄清石灰水中没有沉淀产生;SO2转化成SO3是在催化剂作用下400~500 ℃、常压下进行的。
本题难度:一般
5、选择题 下列溶液:①澄清石灰水;②酸性高锰酸钾溶液;③氯化钡溶液;④品红溶液。能用来区别SO2和CO2气体的是?(?)。
A.①③
B.②③
C.①②
D.②④
参考答案:D
本题解析:SO2和CO2都是酸性氧化物,都能使澄清的石灰水变混浊,但都和氯化钡溶液不反应,所以①③不能区分;SO2还具有还原性和漂白性,但CO2没有,所以②④可以区分,答案选D。2和CO2的鉴别
点评:该题的关键是明确SO2和CO2的性质差异,然后结合题意灵活运用即可。有利于培养学生规范严谨的实验设计能力,同时也有助于提升学生的学科素养,调动学生的学习积极性。
本题难度:一般