微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)碳、氮元素及其化合物与人类的生产生活密切相关。试回答下列有关问题:
(1)?NH3极易溶于水,其水溶液俗称氨水。用水稀释0.1mol·L—1的氨水,溶液中随着水量的增加而减小的是_____________(填序号)

(2)标准状况下,将1.12LCO2通入100mL1mol·L—1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为_________________________________________________;
①c(OH—)=2c(H2CO3)+______________________________________________;
②c(H+)+c(Na+)=___________________________________________________。
(3)甲烷燃料电池中发生的化学反应为:CH4+2O2=CO2+2H2O,该电池的电解质溶液为H2SO4溶液,则 原电池工作时电解质溶液中向正极移动的离子是_____________。
原电池工作时电解质溶液中向正极移动的离子是_____________。
参考答案:(1)b、d(2分,答对1个得1分,答错1个得0分)
(2)c(Na+)>c(CO32-)>c(OH-)>c(HC O3-)>c(H+)(2分)
O3-)>c(H+)(2分)
①c(H+)+c(HCO3-)(2分)
②2c(CO2-3)+(HCO3-)+c(OH-)(2分)
(3)H+(2分)
本题解析:略
本题难度:简单
2、选择题 下图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂的作用下提供质 子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:
2CH3OH+ 3O2=2CO2+4H2O。下列说法正确的是
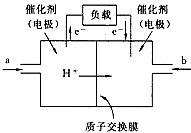
[? ]
A.左边的电极为电池的负极,a处通入的是甲醇
B.右边的电极为电池的负极,b处通入的是空气
C.电池负极的反应式为:CH3OH+H2O-6e-=CO2+6H+
D.电池正极的反应式为:O2+2H2O+4e-=4OH-
参考答案:AC
本题解析:
本题难度:一般
3、填空题 (14分)用CO2生产绿色燃料甲醇时发生反应A:CO2(g)+ 3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(1)2CH3OH(g) + 3O2 (g) ="==" 2CO2(g) + 4H2O(g) △H= -1365.0KJ/mol
H2(g) +1/2 O2 (g) ="==" H2O(g) △H=" -241.8" KJ/mol
CO2(g)+ 3H2(g) CH3OH(g) + H2O(g)的反应热△H= 。
CH3OH(g) + H2O(g)的反应热△H= 。
(2)在体积为1 L的恒容密闭容器中发生反应A,下图是在三种投料[n(CO2)和n(H2)分别为1mol,3mol;1mol,4mol和1mol,6mol]下,反应温度对CO2平衡转化率影响的曲线。

①曲线c对应的投料是 。
②T1℃时,曲线a对应的化学平衡常数是 。
③500℃时 ,反应A的平衡常数K=2.5,T1℃ 500℃(填“高于” 、“低于” 或“等于” )。
(3)甲醇/过氧化氢燃料电池的工作原理示意图如下:
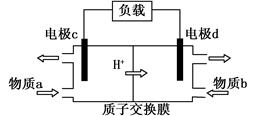
①d电极上发生的是 (填“氧化”或“还原”)反应。
②物质b是 (填化学式)。
③写出c电极的电极反应式 。
参考答案:(1)△H = -42.9kJ/mol(2分)
(2)① n(CO2)=1mol,n(H2)="6mol" (2分) ②0.52(2分) ③高于(2分)
(3)①还原(2分) ②H2O2 (2分)③CH3OH — 6e— + H2O===CO2 + 6H+ (2分)
本题解析:(1)已知:①2CH3OH(g) + 3O2 (g) ="==" 2CO2(g) + 4H2O(g) △H=" -1365.0KJ/mol" ②H2(g) +1/2 O2 (g)===H2O(g)△H="-241.8" KJ/mol,根据盖斯定律:②×3—①×1/2得CO2(g)+3H2(g) CH3OH(g) + H2O(g)的反应热△H=-42.9kJ/mol。(2)①当其他条件不变时,增大反应物氢气的浓度,平衡正向移动,CO2的平衡转化率增大,由题给图像知相同温度下,曲线c二氧化碳的平衡转化率最大,故曲线c对应的投料是n(CO2)=1mol,n(H2)=6mol。②曲线a对应的投料是n(CO2)=1mol,n(H2)=3mol,T1℃时,二氧化碳的平衡转化率为60%,由CO2(g)+3H2(g)
CH3OH(g) + H2O(g)的反应热△H=-42.9kJ/mol。(2)①当其他条件不变时,增大反应物氢气的浓度,平衡正向移动,CO2的平衡转化率增大,由题给图像知相同温度下,曲线c二氧化碳的平衡转化率最大,故曲线c对应的投料是n(CO2)=1mol,n(H2)=6mol。②曲线a对应的投料是n(CO2)=1mol,n(H2)=3mol,T1℃时,二氧化碳的平衡转化率为60%,由CO2(g)+3H2(g) CH3OH(g) + H2O(g)知,各物质的平衡浓度分别为:c(CO2)=0.4mol/L,c(H2)="1.2mol/L" ,c(CH3OH)=0.6mol/L,c(H2O)=0.6mol/L,代入平衡常数表达式计算,曲线a对应的化学平衡常数是0.52。③由(1)知反应为放热反应,升高温度平衡逆向移动,平衡常数减小,若500℃时 ,反应A的平衡常数K=2.5,T1℃高于500℃。(3)①由甲醇/过氧化氢燃料电池的工作原理示意图知,氢离子移向d电极,d电极为电池的正极,发生的是还原反应;②物质b在d电极上发生还原反应,物质b是H2O2。③c电极为电池的负极,甲醇在该电极上反应氧化反应生成二氧化碳,电极反应式为CH3OH — 6e— + H2O===CO2 + 6H+。
CH3OH(g) + H2O(g)知,各物质的平衡浓度分别为:c(CO2)=0.4mol/L,c(H2)="1.2mol/L" ,c(CH3OH)=0.6mol/L,c(H2O)=0.6mol/L,代入平衡常数表达式计算,曲线a对应的化学平衡常数是0.52。③由(1)知反应为放热反应,升高温度平衡逆向移动,平衡常数减小,若500℃时 ,反应A的平衡常数K=2.5,T1℃高于500℃。(3)①由甲醇/过氧化氢燃料电池的工作原理示意图知,氢离子移向d电极,d电极为电池的正极,发生的是还原反应;②物质b在d电极上发生还原反应,物质b是H2O2。③c电极为电池的负极,甲醇在该电极上反应氧化反应生成二氧化碳,电极反应式为CH3OH — 6e— + H2O===CO2 + 6H+。
考点:考查反应热的计算、盖斯定律,化学平衡和燃料电池。
本题难度:困难
4、选择题 生物体中细胞膜内的葡萄糖(C6H12O6)与细胞膜外的碱性富氧液体及细胞膜构成微型的生物原电池.下列有关电极反应及其产物的判断正确的是( )
A.负极反应可能是O 2+2H2O+4e-=4OH-
B.负极反应的产物主要是C6H12O6被氧化生成的CO32-、HCO3-、H2O
C.正极反应可能是C6H12O6+24OH--24e-=6CO2+18H2O
D.正极反应的产物主要是葡萄糖生成的CO2、HCO3-、H2O
参考答案:根据题给信息可知:原电池的负极应为葡萄糖,正极应为O2,由于细胞液呈弱碱性,所以负极反应为C6H12O6+24OH--24e-=6CO2+18H2O,生成的CO2与OH-作用生成CO32-、HCO3-,正极反应为O2+2H2O+4e-=4OH-,
故选B.
本题解析:
本题难度:一般
5、选择题 如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O,在接通电路一段时间后纯Cu质量增加了3.2g.下列说法正确的是( )
A.甲池是电能转化为化学能的装置,乙池是化学能转化电能的装置
B.甲池中理论上消耗标准状况下空气的体积是2.8?L(空气中O2体积分数以20%计算)
C.接通电路一段时间后,乙池中CuSO4溶液的浓度发生了明显的变化
D.甲池通入CH3OH的电极反应为:CH3OH-6e-+2H2O=CO32-+8H+
