微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 相同物质的量的SO2和SO3相比较,下列叙述正确的是( )
①分子数之比为1:1?②所含O原子数之比为2:3?③原子总数之比为3:4?④S原子数之比为1:1?⑤质子数之比4:5.
A.①②③④⑤
B.②③
C.①⑤
D.③④⑤
参考答案:A
本题解析:
本题难度:一般
2、选择题 NA为阿伏加德罗常数的数值,下列说法中正确的是
A.在密闭容器中加入1.5molH2和0.5molN2,充分反应后可得NH3分子数目为NA
B.1.0L 0.1mol?L-1Na2CO3溶液中含有的CO32—离子数目为0.1NA
C.一定条件下,2.3gNa完全与O2反应生成3.6g产物时失去电子数目为0.1NA
D.在标准状况下,2.24L的CH3CH2OH含有NA个分子
参考答案:C
本题解析:A、该反应为可逆反应不能进行完全,故充分反应后可得NH3分子数目小于NA;B、1.0L0.1mol?L-1Na2CO3溶液中含有的CO32-离子数目小于0.1NA,因为CO32—会发生水解;C正确;D、 在标准状况下,2.24L的CH3CH2OH含有0.1NA个分子。
本题难度:一般
3、选择题 关于0.1 mol/L Na2CO3溶液的叙述错误的是
[? ]
A.1 L该溶液中含有Na2CO3的质量为106 g
B.0.5 L该溶液中钠离子的物质的量浓度为0.2 mol/L
C.从1L该溶液中取出100 mL,则取出溶液中Na2CO3的物质的量浓度为0.?01mol/L
D.取该溶液10 mL,加水稀释至100 mL后,Na2CO3的物质的量浓度为0.?01mol/L
参考答案:AC
本题解析:
本题难度:简单
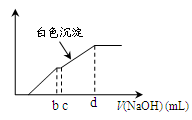
4、选择题 向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH(aq),生成沉淀的质量与滴入NaOH(aq)的体积关系如图。原混合溶液中MgCl2与FeCl3的物质的量之比为
A.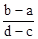
B.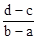
C.
D.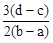
参考答案:D
本题解析:向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,首先发生反应NaOH+HCl=NaCl+H2O,即为图象中0-amL,沉淀的质量为0g;FeCl3只能在酸性较强的溶液中存在,当酸性减弱时,会转化为Fe(OH)3沉淀,从amL开始,bmL时沉淀完全.bmL时,溶液仍然呈酸性,到cmL时,才开始产生Mg(OH)2沉淀,令氢氧化钠浓度为xmol/L,Fe3+完全沉淀消耗氢氧化钠为(b-a)mL,结合Fe3++3OH-═Fe(OH)3↓可知,溶液中n(Fe3+)=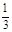 ×(b-a)×10-3Lxmol/L,
×(b-a)×10-3Lxmol/L,
Mg2+完全沉淀消耗氢氧化钠为(d-c)mL,结合Mg2++2OH-═Mg(OH)2↓可知,溶液中n(Mg2+)= ×(d-c)×10-3Lxmol/L,故原混合溶液中n(MgCl2):n(FeCl3)=
×(d-c)×10-3Lxmol/L,故原混合溶液中n(MgCl2):n(FeCl3)= ×(d-c)×10-3Lxmol/L:
×(d-c)×10-3Lxmol/L: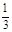 ×(b-a)×10-3Lxmol/L=3(d-c):2(b-a),故选D。
×(b-a)×10-3Lxmol/L=3(d-c):2(b-a),故选D。
本题难度:一般
5、选择题 在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为 (? )
A.0.1mol
B.0.5mol
C.0.15mol
D.0.25mol
参考答案:B
本题解析:由电荷守恒:1.5mol×1+0.5mol×2=1.5mol×1+n(SO42-)×2, n(SO42-)=0.5mol,选B。
本题难度:一般