微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该物质固体的是 (?)
①AlCl3;②NaHCO3 ;③NaAlO2;④MgSO4 ;⑤Na2SO3 ;⑥KMnO4;⑦Fe2(SO4)3;⑧FeCl2
A.①②⑤
B.⑥⑦⑧
C.③④⑦
D.④⑤⑥
参考答案:C
本题解析:①AlCl3是强酸弱碱盐,加热发生水解反应产生氢氧化铝和氯化氢,氯化氢有挥发性,所以随着不断加热水分的蒸发,氯化氢气体也不断逸出,蒸干得到的固体是Al(OH)3. 灼烧发生反应2Al(OH)3 Al2O3+3H2O.故蒸干并灼烧得到的固体是Al2O3。②发生反应2NaHCO3
Al2O3+3H2O.故蒸干并灼烧得到的固体是Al2O3。②发生反应2NaHCO3 Na2CO3+CO2↑+H2O。最后得到的固体是Na2CO3。③NaAlO2是强碱弱酸盐,水解产生氢氧化钠和氢氧化铝,由于氢氧化钠没有挥发性,随着反应的不断进行,水分的不断蒸发,氢氧化钠和氢氧化铝又重新反应产生NaAlO2和水。所以最后得到NaAlO2固体。④MgSO4是不挥发性的强酸与弱碱反应生成的盐,水解产生的酸碱会重新生成MgSO4和水。最后得到的固体是MgSO4。⑤Na2SO3是还原性的弱酸H2SO3与强碱NaOH反应生成的盐。在加热的过程中水解产生的H2SO3会被氧化成H2SO4,H2SO4和NaOH反应生成难挥发的强酸强碱盐Na2SO4和水。所以最后的固体是Na2SO4。⑥KMnO4是强酸强碱盐,在溶液中不发生水解反应,但在蒸干后加热会发生分解反应:2KMnO4
Na2CO3+CO2↑+H2O。最后得到的固体是Na2CO3。③NaAlO2是强碱弱酸盐,水解产生氢氧化钠和氢氧化铝,由于氢氧化钠没有挥发性,随着反应的不断进行,水分的不断蒸发,氢氧化钠和氢氧化铝又重新反应产生NaAlO2和水。所以最后得到NaAlO2固体。④MgSO4是不挥发性的强酸与弱碱反应生成的盐,水解产生的酸碱会重新生成MgSO4和水。最后得到的固体是MgSO4。⑤Na2SO3是还原性的弱酸H2SO3与强碱NaOH反应生成的盐。在加热的过程中水解产生的H2SO3会被氧化成H2SO4,H2SO4和NaOH反应生成难挥发的强酸强碱盐Na2SO4和水。所以最后的固体是Na2SO4。⑥KMnO4是强酸强碱盐,在溶液中不发生水解反应,但在蒸干后加热会发生分解反应:2KMnO4 K2MnO4+MnO2+O2↑.所以最后得到固体是K2MnO4和MnO2的混合物。⑦Fe2(SO4)3是难挥发的强酸H2SO4和弱碱Fe(OH)3反应产生的盐。在溶液中水解得到H2SO4和Fe(OH)3。由于H2SO4无挥发性,所以二者会在加热的过程中重新反应产生Fe2(SO4)3和水。最后随着水分的蒸干而得到Fe2(SO4)3,灼烧不会发生分解反应。因此加热蒸干并灼烧得到的固体产物是Fe2(SO4)3。⑧FeCl2是挥发性的强酸与弱碱Fe(OH)2反应生成的盐。水解产生的HCl会不断挥发逸出,产生的Fe(OH)2会被空气中的氧气氧化形成Fe(OH)3.所以蒸干得到的固体是Fe(OH)3。灼烧时发生分解反应:2Fe(OH)3
K2MnO4+MnO2+O2↑.所以最后得到固体是K2MnO4和MnO2的混合物。⑦Fe2(SO4)3是难挥发的强酸H2SO4和弱碱Fe(OH)3反应产生的盐。在溶液中水解得到H2SO4和Fe(OH)3。由于H2SO4无挥发性,所以二者会在加热的过程中重新反应产生Fe2(SO4)3和水。最后随着水分的蒸干而得到Fe2(SO4)3,灼烧不会发生分解反应。因此加热蒸干并灼烧得到的固体产物是Fe2(SO4)3。⑧FeCl2是挥发性的强酸与弱碱Fe(OH)2反应生成的盐。水解产生的HCl会不断挥发逸出,产生的Fe(OH)2会被空气中的氧气氧化形成Fe(OH)3.所以蒸干得到的固体是Fe(OH)3。灼烧时发生分解反应:2Fe(OH)3 Fe2O3+3H2O.因此在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该物质固体的是③④⑦。
Fe2O3+3H2O.因此在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该物质固体的是③④⑦。
本题难度:一般
2、选择题 短周期元素W、X、Y、Z的原子序数依次增大,且W、X、Y+、Z的最外层电子数与其电子层数的比值依次为2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述错误的是?
[? ]
A.X和其他他种元素均可形成至少2种的二元化合物
B.W和X、Z两种元素分别形成的二元化合物中,均有直线形分子
C.W、X和Y三种元素可以形成碱性化合物
D.Z和其他三种元素形成的二元化合物,其水溶液均呈酸性
参考答案:D
本题解析:
本题难度:一般
3、选择题 短周期元素X、Y、Z在周期表中的位置如图所示,下列说法正确的是
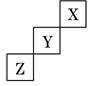
[? ]
A.X的非金属性最强
B.X单质的熔点比Z低
C.Z的氢化物的稳定性比Y强?
D.Y的最高正化合价为+7
参考答案:B
本题解析:
本题难度:一般
4、选择题 2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于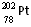 的说法正确的是
的说法正确的是
[? ]
A.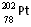 和
和 的质子数相同,互称为同位素
的质子数相同,互称为同位素
B.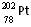 和
和 的中子数相同,互称为同位素
的中子数相同,互称为同位素
C.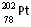 和
和 的核外电子数相同,是同一种核素
的核外电子数相同,是同一种核素
D.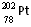 和
和 的质量数不同,不能互称为同位素
的质量数不同,不能互称为同位素
参考答案:A
本题解析:
本题难度:简单
5、填空题 磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为______.
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2=6CaSiO3+P4O1010C+P4O10=P4↑+10CO↑,上述反应中的各种物质,属于酸性氧化物的有______.
(3)白磷有剧毒,不慎沾到皮肤上,可用CuSO4溶液冲洗解毒.白磷可与热的CuSO4溶液反应生成磷化亚铜,与冷溶液则析出铜,反应方程式分别(均未配平)为:①P4+CuSO4+H2O→Cu3P+H3PO4+H2SO4②P4+CuSO4+H2O→Cu+H3PO4+H2SO4反应①中,氧化剂为______,若上述两反应中被氧化的P4的物质的量相等,则消耗的CuSO4的物质的量之比为______.
参考答案:(1)在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数.因为质子数和中子数之和是质量数,P元素的原子序数是15,所以表示该核素的原子符号为3115P,故答案为:3115P;
(2)能和碱反应生成盐和水的氧化物是酸性氧化物,所以属于酸性氧化物的是SiO2、P4O10,故答案为:SiO2、P4O10;
(3)反应①中,硫酸铜中铜的化合价从+2价降低到+1价,得到电子,被还原,发生还原反应,因此硫酸铜是氧化剂.另外P元素的化合价从0价部分降低到-3价,得到电子,影响白磷也是氧化剂.如果被氧化的白磷都是1mol,则反应中转移电子是20mol,所以根据电子的得失守恒可知,反应①中需要硫酸铜是20/6×3=10mol.而在反应②需要硫酸铜是20×12=10mol,所以消耗的CuSO4的物质的量之比为1:1,故答案为:CuSO4和P4;1:1.
本题解析:
本题难度:一般