微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室制Cl2的反应为4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O.下列说法错误的是( )
A.还原剂是HCl,氧化剂是MnO2
B.每生成1mol Cl2,转移电子的物质的量为2 mol
C.每消耗1mol MnO2,起还原剂作用的HCl消耗4mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
参考答案:C
本题解析:
本题难度:一般
2、选择题 关于下列各装置图的叙述中,正确的是

[? ]
A.实验室用装置①制取氨气
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④是原电池,锌电极为负极,发生氧化反应
参考答案:BD
本题解析:
本题难度:一般
3、简答题 实验室模拟合成氨和氨催化氧化的流程如下:?

已知
A.实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
B.锥形瓶中的铂丝是氨催化氧化反应的催化剂
(1)从上图中选择制取气体的合适装置:氮气______、氢气______.
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还可以______、______.
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,______(“会”或“不会”)发生倒吸,原因是______.
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:______,锥形瓶中还可观察到的现象是:______.
(5)写出乙装置中氨氧化的化学方程式:______.
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、______、______离子.
参考答案:(1)实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,可以选择a,实验室里用金属锌粒和稀硫酸反应制取氢气,可以选择装置b,
故答案为:a;b;
(2)氮气和氢气通过甲装置,甲装置中的浓硫酸可以将氮气和氢气干燥,同时可以根据甲装置中冒气泡的速率来控制气体流量,故答案为:干燥气体;控制氢气和氮气的流速;
(3)合成氨的反应是可逆的,还会有一些氮气、氢气存在,这样会缓解氨气极易溶于水导致的气压差,不会倒吸,故答案为:因为混合气体中含有大量难溶于水的氮气、氢气两种气体;
(4)氨的催化氧化反应是一个放热反应,将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热,同时氨催化氧化产物一氧化氮极易变为二氧化氮,二氧化氮是红棕色气体,
故答案为:表明氨的催化氧化反应是一个放热反应;有红棕色气体产生;
(5)氨的催化氧化反应产物是一氧化氮和水,即4NH3+5O2催化剂.△4NO+6H2O,故答案为:4NH3+5O2催化剂.△4NO+6H2O;
(6)氨的催化氧化反应产物是一氧化氮和水,一氧化氮极易变为二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,所以硝酸的存在会和氨水反应生成硝酸铵,溶液中会存在H+、OH-、NH4+、NO3-,故答案为:NH4+;NO3-.
本题解析:
本题难度:一般
4、简答题 某化学兴趣小组利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气发生反应的装置.
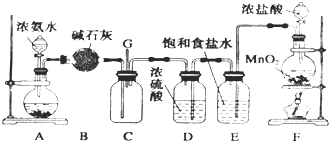
请回答下列问题:
(1)装置A中的固体物质不宜选用______(填字母编号).
a.无水氯化钙b.氢氧化钠c.氧化钙d.碱石灰e.无水硫酸铜
(2)写出装置F中发生反应的离子方程式:______;E装置的作用为______.
(3)通入C装置的两根导管左边较长、右边较短,原因是____________.
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.当有0.15molCl2参与反应时,则生成的气体在标准状况下的体积为______.
(5)上述装置还存在一处明显的缺陷,你认为改进的措施是______.
参考答案:(1)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,b.氢氧化钠溶解于水时放出热量c.氧化钙和水反应生成碱且放出大量热,d.碱石灰是碱性物质,且溶于水时放热,a.无水氯化钙溶于水呈中性,且与氨气反应,e.无水硫酸铜溶于水时吸热,
故选ae;
(2)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,MnO2+4H++2C1-△.Mn2++C12↑+2H2O,E中装有饱和食盐水,食盐水中含有氯离子,能抑制氯气的溶解,装置的作用为除去氯气中混有的氯化氢,
故答案为:MnO2+4H++2C1-△.Mn2++C12↑+2H2O;除去氯气中混有的氯化氢;
(3)左边进入的为氨气,右边进入的为氯气,密度不同,则导管左边较长、右边较短使密度大的氯气与密度小的氨气较快地均匀混合,
故答案为:使密度大的氯气与密度小的氨气较快地均匀混合;
(4)C内出现浓厚的白烟为氯化铵,另一生成物是空气的主要成分之一为氮气,该反应为3Cl2+8NH3═N2+6NH4Cl,当有0.15molCl2参与反应时,
3Cl2 +8NH3 ═N2 +6NH4Cl
3mol 1mol
0.15mol n(N2)
n(N2)=0.05mol,V=n×Vm=0.05mol×22.4mol/L=1.12L,
故答案为:1.12L;
(5)氯气是有毒的气体,缺少尾气处理装置,可用碱液进行吸收,
故答案为:在G处连接一尾气处理装置;
本题解析:
本题难度:一般
5、简答题 某研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,锰化合物的还原产物都是MnCl2(如:K2MnO4+8HCl═MnCl2+2Cl2↑+2KCl+4H2O).他们又进行了以下一些有关定量的实验,按要求填空或计算(气体体积都折合成标准状况).
(1)称取了15.8g?KMnO4粉末,放在试管中加热充分反应后,收集到气体的体积是______;另取31.6g?KMnO4粉末和足量盐酸反应,收集到气体体积是______.
(2)将31.6g?KMnO4粉末加热一段时间,收集到1.12L气体后停止加热,冷却后放入足量的浓盐酸再加热,又收集到气体体积是______.
(3)将a?mol?KMnO4粉末加热一段时间,收集到V1L气体后停止加热,冷却后放入足量的浓盐酸再加热反应充分后,又收集到气体体积V2L.则V2=______(用a、V1表达).
参考答案:(1)15.8g?KMnO4粉末物质的量=15.8g158g/mol=0.1mol,放在试管中加热充分反应,
化学方程式为2KMnO4?加热?.?K2MnO4+MnO2+O2↑,生成氧气物质的量为0.05mol,
所以氧气的体积在标准状况下=0.05mol×22.4L/mol=1.12L;
取31.6g?KMnO4粉末和足量盐酸反应生成的气体是氯气,31.6g?KMnO4粉末物质的量=31.6g158g/mol=0.2mol;
反应的化学方程式为:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,根据反应中的定量关系2KMnO4~5Cl2,
0.2mol高锰酸钾反应生成0.5mol氯气,标准状况下的体积=0.5mol×22.4L/mol=11.2L;
故答案为:1.12 L 11.2 L
(2)31.6g?KMnO4粉末加热一段时间,收集到1.12L气体后停止加热,根据化学方程式,
2KMnO4?加热?.?K2MnO4+MnO2+O2↑,此时生成的气体是氧气0.05mol,生成锰酸钾0.05mol,二氧化锰0.05mol,分解的高锰酸钾0.1mol,剩余高锰酸钾0.1mol;根据氧化还原反应的电子守恒,这些氧化剂得到电子,锰元素最终变为锰离子,和浓盐酸反应,氯离子失去电子变为氯气,得失电子是相同的,根据电子守恒计算;
得到电子的物质:KMnO4~Mn2+~5e-,K2MnO4~Mn2+~4e-,MnO2~Mn2+~2e-,
?0.1mol? ?0.5mol?0.05mol?0.2mol? 0.05mol? 0.1mol
共得到电子物质的量=0.1mol+0.2mol+0.5mol=0.8mol;
失电子的物质是氯化氢:2Cl-~Cl2~2e-?
?0.4mol? 0.8mol
所以生成的氯气标准状况下的体积=0.4mol×22.4L/mol=8.96L
故答案为:8.96L;
(3)将a?mol?KMnO4粉末加热一段时间,收集到V1?L气体为氧气后停止加热,冷却后放入足量的浓盐酸再加热反应充分后,又收集到气体体积V2?L
根据(2)的分析可知高锰酸钾得到的电子最终变为锰离子,其中有一部分生成了氧气,其他变化生成了氯气,依据氧化还原反应中的电子守恒得到:
失去电子的变化:KMnO4~O2~4e-? 2Cl-~Cl2~2e-?
? V122.4L/mol? 4V122.4L/mol
得到电子的变化:KMnO4~Mn2+~5e-,除去生成氧气得到的电子,锰元素变为锰离子得到的电子全部生成氯气,所以生成氯气得到的电子物质的量=5amol-4V122.4L/mol
?由电子守恒可知:2Cl-~Cl2~2e-?
生成氯气在标准状况下的体积=(5amol-4V122.4L/mol)×12×22.4L/mol=56a-2V1
故答案为:56a-2V1
本题解析:
本题难度:一般