微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 温度一定时,用水稀释0.1mol/L氨水时,溶液中随着加水量的增加而减小的是(?)
A.c(OH-)
B.c(OH-)/c(NH3·H2O)
C.c(H+)和c(OH-)的乘积
D.OH-的物质的量
参考答案:A
本题解析:稀释碱液,碱性减弱,c(OH-)减小。根据电离平衡常数可知,c(OH-)/c(NH3·H2O)
增大。c(H+)和c(OH-)的乘积只与温度有关,温度一定时其乘积一定。稀释促进电离,平衡正向移动,所以OH-的物质的量增大,但浓度减小。故选A
本题难度:一般
2、填空题 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是______(填”A”或”B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1______m2.(选填”<“、”=“或”>“)
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g).该反应的平衡常数表达式K=______,升高温度,K值______(填”增大”“减小”或”不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______.
(3)难溶电解质在水溶液中存在着溶解平衡.在某温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:Mg(OH)2(s)?Mg2+?(aq)+2OH-?(aq),某温度下Ksp=c(Mg2+)[c(OH-)]2=2×10-11.若该温度下某MgSO4溶液里c(Mg2+)=0.002mol?L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于______;该温度下,在0.20L的0.002mol?L-1MgSO4溶液中加入等体积的0.10mol?L-1的氨水溶液,该温度下电离常数K(NH3?H2O)=2×10-5,经计算______(填”有”或”无”)Mg(OH)2沉淀生成.
(4)常温下,向某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈______性.在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的C
水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论).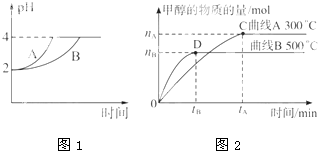
参考答案:(1)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<;
(2)因化学平衡常数等于生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积,所以K=c(CH3OH)c(CO)c2(H2),由图可知,升高温度,甲醇的含量降低,平衡逆向移动,则化学平衡常数减小,由图象可知,在500℃时,2min到达平衡,甲醇的平均反应速率v(CH3OH)=nB3LtB?mol?(L?min)-1 =nB3tBmol?(L?min)-1 ,由速率之比等于化学计量数之比求出,则v(H2)=2v(CH3OH)=2nB3tBmol?(L?min)-1;
故答案为:K=c(CH3OH)c(CO)c2(H2),减小,2nB3tB mol?(L?min)-1;
(3)c(OH-)=
本题解析:
本题难度:一般
3、选择题 在稀CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO- + H+,下列叙述正确的是
CH3COO- + H+,下列叙述正确的是
A.加入水时,平衡左移
B.加入少量0.1mol/LHCl溶液,溶液中c(H+)减小
C.加入少量NaOH固体,平衡右移
D.加入少量CH3COONa固体,平衡右移
参考答案:C
本题解析: A、加入水时,c(H+)降低,平衡右移,错误;B、HCl在溶液中可以完全电离,溶液中的c(H+)增加,错误;C、加入NaOH,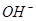 会中和H+,使平衡右移,正确;D、加入
会中和H+,使平衡右移,正确;D、加入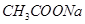 ,使c(
,使c(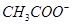 )升高,平衡左移,错误。
)升高,平衡左移,错误。
本题难度:一般
4、选择题 相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应
A.强酸溶液产生较多的氢气
B.两者产生等量的氢气
C.无法比较两者产生氢气的量
D.弱酸溶液产生较多的氢气
参考答案:D
本题解析:强酸完全电离,弱酸部分电离。当二者的体积相同,溶液的pH也相同时,弱酸溶液最终电离产生的H+的物质的量多,所以最终与足量的活泼金属Mg发生反应放出的氢气多。因此选项为D。
本题难度:一般
5、选择题 下列说法中,错误的是
A.NaHCO3溶液中碳元素主要以HCO3-存在
B.Na2CO3溶液中滴加酚酞呈红色,加热红色变深
C.NH4Cl溶液呈酸性这一事实能说明一水合氨为弱碱
D.在稀醋酸中加醋酸钠固体能促进醋酸的电离
参考答案:D
本题解析:A.NaHCO3溶液中,HCO3 既电离产生CO3
既电离产生CO3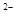 ,又水解生成H
,又水解生成H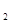 CO3,但电离、水解程度都很微弱,所以HCO3
CO3,但电离、水解程度都很微弱,所以HCO3 还是大量存在,碳元素主要以HCO3-存在。不符合条件。
还是大量存在,碳元素主要以HCO3-存在。不符合条件。
B.Na2CO3溶液水解显碱性,所以滴加酚酞会呈红色,加热能促进水解,使溶液碱性增强,红色加深。不符合条件
C.NH4Cl溶液呈酸性,而盐酸为强酸,说明该盐为强酸弱碱盐,能说明一水合氨为弱碱。不符合条件
D.在稀醋酸中加醋酸钠固体,醋酸根离子浓度增大,电离平衡向左移动,抑制了醋酸的电离。符合条件。
故选D
本题难度:一般