微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是
A.定容时俯视液面
B.所用NaOH已潮解
C.未洗涤溶解NaOH固体的烧杯
D.定容时仰视液面
参考答案:A
本题解析:A、定容时俯视液面:实际水位比刻线低,水没加够,浓度偏高;B、所用NaOH已潮解,称得固体的质量包括水,浓度偏低;C、未洗涤溶解NaOH固体的烧杯:烧杯壁粘有溶质,浓度偏低;D、定容时仰视液面:实际水位比刻线高,水加多了,浓度偏低。
本题难度:一般
2、计算题 2.16g X2O5中含有0.1mol 氧原子,求X的摩尔质量。
参考答案:14g/mol
本题解析:假设X2O5中X的摩尔质量为ag/mol,则有整个X2O5的摩尔质量表示为:2a+5×16=(2a+80)g/mol。2.16gX2O5物质的量为2.16/(2a+80)mol.
由于题目给出氧原子物质的量为0.1mol,所以有5·[2.16/(2a+80)]=0.1
求出a=14g/mol
本题难度:一般
3、选择题 若NA表示阿伏加德罗常数的值,在4(NH4)2SO4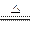 N2+6NH3+3SO2+SO3+7H2O的反应中,当有NA个电子发生转移时,以下说法错误的是(? )
N2+6NH3+3SO2+SO3+7H2O的反应中,当有NA个电子发生转移时,以下说法错误的是(? )
A.有 NA个硫原子被还原
NA个硫原子被还原
B.有 NA个氮原子被氧化
NA个氮原子被氧化
C.有 NA个二氧化硫分子生成
NA个二氧化硫分子生成
D.有 NA个硫酸铵分解
NA个硫酸铵分解
参考答案:C
本题解析:生成3 mol SO2应有3×(6-4) mol="6" mol 电子发生转移,现有NA个电子转移,则有6∶3=NA∶x,x= Na,所以反应中有NA个电子发生转移,应有
Na,所以反应中有NA个电子发生转移,应有 NA个SO2分子生成。
NA个SO2分子生成。
本题难度:简单
4、选择题 配制100mL 1mol/LNaOH溶液,下列操作中正确的是
A.在托盘天平两托盘上各放一片相同的纸,然后将NaOH放在纸片上进行称量
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.用蒸馏水洗涤烧杯、玻璃棒2---3次,洗涤液也移入容量瓶中
D.沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹面恰好与刻度相切
参考答案:C
本题解析:
解决本题学生应有较好的实验技能。
A:中称量NaOH应放在烧杯中。
B:超过容量瓶刻度线后实验失败,应重做。
C:正确,洗涤可以防止溶质的非正常损失。
D:加蒸馏水时应在离刻度线1-2厘米时改用胶头滴管;加水到水平观察凹面最低处刚好与刻度线相切。
本题难度:一般
5、选择题 a mol铜跟含b mol HNO3的硝酸溶液恰好完全反应,则被还原的HNO3的物质的量一定是
A.(b-2a) mol
B.b/4 mol
C.2a/3 mol
D.2a mol
参考答案:A
本题解析:根据原子守恒可知,生成硝酸铜一定是amol,则未被还原的硝酸是2amol,所以被还原的硝酸是(b-2a)mol,答案是A。
点评:硝酸与金属反应时,硝酸除了做氧化剂之外还有酸的作用。
本题难度:一般