微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和生活质量的提高。下列各图所示的措施中,是为了增大化学反应速率的是( )。
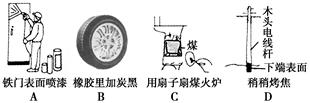
参考答案:C
本题解析:A项为防止铁门生锈,B项为防止橡胶老化,D项为防止木头腐烂,三者均为了减慢化学反应速率。C项是为了使炉火更旺,加快化学反应速率。
本题难度:简单
2、选择题 把下列四种碳酸氢钠溶液分别加入四个盛有10mL?2mol?L-1盐酸的烧杯中,均加水稀释到50mL,此时碳酸氢钠和盐酸反应,其中反应开始时速率最大的是( )
A.10℃20mL3mol?L-1的碳酸氢钠溶液
B.20℃30mL2mol?L-1的碳酸氢钠溶液
C.20℃10mL4mol?L-1的碳酸氢钠溶液
D.10℃20mL2mol?L-1的碳酸氢钠溶液
参考答案:A、20mL3 mol?L-1的碳酸氢钠溶液,稀释到50mL时浓度为1.2mol?L-1;
B、20mL3mol?L-1的碳酸氢钠溶液,稀释到50mL时浓度为1.2mol?L-1;
C、10mL4mol?L-1的碳酸氢钠溶液,稀释到50mL时浓度为0.8mol?L-1;
D、20mL2mol?L-1的碳酸氢钠溶液,稀释到50mL时浓度为0.8mol?L-1,
显然四种情况下10mL?2mol?L-1盐酸,加水稀释到50mL时浓度均为.4mol?L-1,
因为B中温度最高,浓度最大,所以反应速率是最大的,
故选:B.
本题解析:
本题难度:简单
3、填空题 在密闭容器里,通入x mol H2和y mol I2 (g),改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1) 升高温度?;
(2) 加入催化剂?;
(3) 充入更多的H2?;
(4) 扩大容器的体积?;
(5) 容器容积不变,通入氖气?。
参考答案:(1)增大; (2)增大; (3)增大; (4)减小; (5)不变
本题解析:升高温度、加入催化剂均可以加快反应速率。增大氢气的浓度反应速率也是增大的。扩大容器的体积,压强减小,反应速率降低;容器容积不变,通入氖气,压强增大,但气体的浓度不变,反应速率不变。
点评:该题是高考中的常见题型,属于基础知识试题的考查。试题紧扣教材,旨在巩固学生的基础,提高学生的应试能力。该题的关键是明确外界条件是如何影响反应速率的,然后结合题意灵活运用即可。有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
4、填空题 某学生为了探究Zn与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的Zn粉,用排水集气法收集反应放出的H2,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5
氢气体积(mL)
50
120
232
290
310
|
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大______min,你认为原因是______;
(2)4~5min时间段的反应速率最小,你认为原因是______;
(3)求2~3min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)=______mol/(L?min);
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:A.H2OB.NaCl溶液C.Na2CO3溶液D.Cu粉E.CuSO4粉末;
你认为可行的是(填编号)______.
参考答案:(1)从表中数据看出2 min~3 min收集的氢气比其他时间段多,反应速率最大,虽然反应中c(H+)下降,但主要原因是Zn置换H2的反应是放热反应,温度升高,
故答案为:2~3;该反应是放热反应,2~3min时温度高,温度对反应速率影响占主导作用;
(2)4 min~5 min收集的氢气最少,反应速率最小,虽然反应中放热,但主要原因是c(H+)下降,反应物浓度越低,反应速率越小,
故答案为:4~5min时H+浓度小,浓度对反应速率影响占主导作用;
(3)2~3 min生成氢气的体积是112 mL,设需要盐酸的物质的量为xmol,
Zn+2HCl=ZnCl2 +H2 ↑
2mol 22.4L
xmol0.112L
x=0.01
所以△c(HCl)=0.01mol0.1L=0.1mol/L.
所以v(HCl)=0.1mol/L1min=0.1mol/(L.min),
故答案为:0.1mol/(L.min);
(4)A、加入蒸馏水,溶液中H+的浓度减小,反应速率减小,H+的物质的量不变,氢气的量也不变,故A正确;
B、加入氯化钠溶液,减小盐酸的浓度,反应速率减小,H+的物质的量不变,氢气的量也不变,故B正确;
C、加入Na2CO3溶液,Na2CO3能与盐酸反应,H+的浓度减小,反应速率减小,H+的物质的量减小,氢气的量也减小,故C错误;
D、加入Cu粉,锌、铜、稀盐酸形成原电池,加快了化学反应速率,因Zn足量,则氢气的量不变,H+的物质的量不变,氢气的量也不变,故C错误;
E、加入CuSO4溶液,锌能置换出铜,锌、铜、稀盐酸形成原电池,加快了化学反应速率,因Zn足量,则氢气的量不变,故D错误;
故答案为:AB.
本题解析:
本题难度:一般
5、选择题 实验中要快速制取氢气,最好的方法是
A.纯锌和稀硫酸反应
B.纯锌和浓硫酸反应
C.粗锌和浓硫酸反应
D.粗锌与稀硫酸反应
参考答案:D
本题解析:制取氢气需要用稀硫酸和锌,由于增大反应物浓度可以加快反应速率,所以硫酸的浓度可以适当增大,但是不能用浓硫酸,浓硫酸有强氧化性与金属锌不生成氢气,故B、C错误;又由于形成原电池的反应可以加快反应速率,所以用粗锌可以加快反应速率,故选D。
本题难度:一般